¿Qué es el agua oxigenada?
Compuestos y propiedades Limpieza e higiene Salud y belleza
Química sostenible: Energía, mediaombiente y ciudades sostenibles, Salud y bienestar

Este compuesto de fórmula sencilla, tan conocido en los hogares para curar las heridas de pequeños y mayores, se emplea además en productos de peluquería para modificar el color del cabello y en las naves espaciales como propelente y combustible. Desde que en el siglo XIX lo descubriera el científico Louis Thénard, su uso se ha extendido de manera generalizada. También, se conoce como peróxido de hidrógeno y su fórmula química es H2O2.
Esta sustancia líquida, incolora y de olor penetrante, muy presente en los hogares hoy día, comenzó su andadura comercial tras su descubrimiento en el siglo XIX. A España llegaría en los años 20. Su denominación técnica está determinada por la IUPAC, la Unión Internacional de Química Pura y Aplicada, una organización internacional que, entre otras cosas, se encarga de dictar las normas de nomenclatura de las moléculas. En el caso del ‘agua oxigenada’ su designación sería peróxido de hidrógeno, dioxano o dióxido de dihidrógeno. No obstante, se le conoció en un principiotal como lo nombró su descubridor, Thénard (1777-1857), cuando en 1818 lo obtuvo por vez primera atacando con ácidos el peróxido de bario (BaO2) y se asombró del porcentaje tan alto de oxígeno que contenía el producto final. En España se registró y comercializó como ‘Agua oxigenada neutra medicinal’ bajo la propiedad de Grau & Cía. a finales de 1926, una empresa creada a principios del siglo XX como el ‘Laboratorio del Doctor Grau S. A.’. El Centro Cultural La Corrala – Museo de Artes y Tradiciones Populares de la Universidad Autónoma de Madrid tiene un frasco de agua oxigenada de esta fecha.
BaO2 + 2 HCl → BaCl2 + H2O2

Izquierda: Louis Jacques Thenard (1777-1857). Biblioteca Interuniversitaria de Medicina, París. Derecha: Botella de la Universidad Complutense de Madrid de agua oxigenada de 1926
Esta molécula es capaz de descomponerse liberando agua y oxígeno, que da lugar a la espuma que observamos al aplicarla en las heridas, en una reacción química que desprende calor, es decir, que es exotérmica. Esto puede darse también de forma espontánea por acción directa de la luz, es decir, por una reacción fotoquímica, por lo que se almacena en botes opacos que no dejan traspasarla.
2 H2O2 → 2 H2O + O2
La reacción de descomposición se puede, además, reproducir en casa con ingredientes convencionales como sangre, trozos de carne, patata o zanahoria debido a una molécula presente en los tejidos de los organismos, que recibe el nombre de enzima catalasa, responsable de generar la espuma como también lo son otras sustancias químicas como el yoduro de potasio.
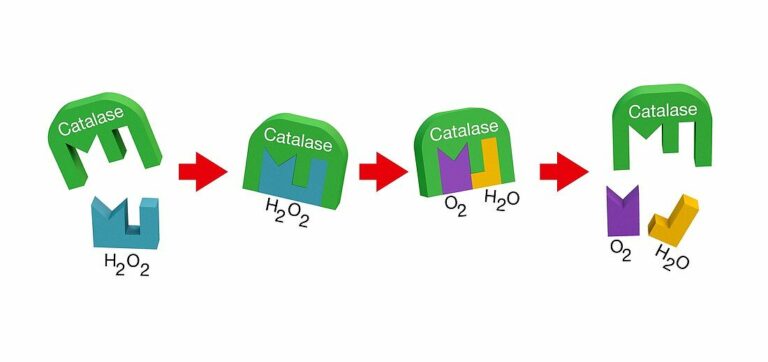
Imagen de acción de la Catalasa con el agua oxigenada de Jensen, Mikkel Juul
¿Qué es la catalasa y por qué ataca al agua oxigenada?
Se trata de una proteína presente en todas las células eucariotas que se encarga de destruir el peróxido de hidrógeno ya que esta molécula es tóxica para los seres vivos. Es por esto que en las células de animales, plantas y hongos, y en la mayoría de bacterias aerobias, existen unos orgánulos llamados peroxisomas que, entre otras funciones, se encargan de destruir el peróxido de hidrógeno procedente de reacciones químicas del metabolismo mediante el empleo de catalasa. De esta manera, los seres vivos evitan la posible intoxicación por estos residuos que se forman de manera natural, aunque no deseada, dentro de las células, ya que la catalasa reconoce la molécula y la transforma de manera efectiva en compuestos inocuos.
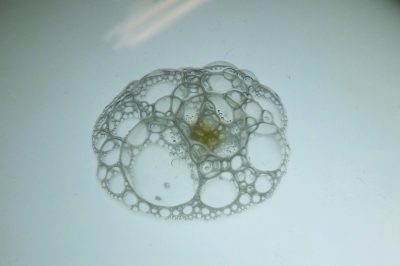
Prueba de la catalasa en Staphylococos Aureus con agua oxigenada al 30%. Autores: David Torrens González, Marta Martín García
La catalasa ha sido ampliamente estudiada y se conoce bien su estructura y su mecanismo. En el Protein Data Bank se recoge toda la información referente a proteínas y biomoléculas descubiertas a nivel mundial, incluyendo una imagen 3D interactiva de la catalasa humana presente en los eritrocitos, también llamados glóbulos rojos.
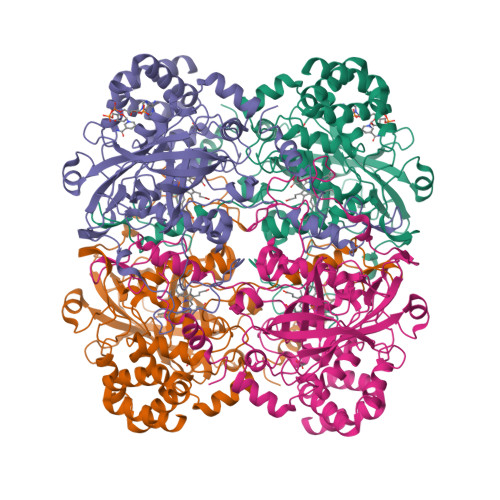
Catalasa humana presente en los glóbulos rojos. PDB https://doi.org/10.2210/pdb1DGF/pdb
¿Cómo encontramos esta sustancia en el mercado y cuáles son sus usos?
El agua oxigenada se encuentra accesible a las personas mezclada con agua en diversas proporciones según sus aplicaciones.
1..El recipiente que encontramos en la tienda o la farmacia indica un porcentaje generalmente del 3%. Esto se refiere a la concentración en la que se presenta, que se expresa en volúmenes, e indica la cantidad de oxígeno que se desprende durante la descomposición (en condiciones ordinarias de presión y temperatura). Así, un agua oxigenada del 3 % es de unos 10 volúmenes y una del 6% corresponderá a 20 volúmenes, por lo que se desprende más cantidad del gas.
La versión comercial más diluida es utilizada, por lo tanto, como desinfectante. En una herida en la que añadimos agua oxigenada podemos observar ese desprendimiento de oxígeno como una espuma. La espuma característica se forma porque el enzima catalasa presente en nuestros tejidos la descompone instantáneamente.
Aunque actualmente no se aplica con frecuencia como desinfectante, dado que hay bacterias que pueden defenderse de ella mediante reacciones enzimáticas, su acción antiséptica y la capacidad de ser coagulante en casos de pequeñas hemorragias la sigue haciendo interesante. También se utiliza en ocasiones en afecciones de garganta y de boca.

Espuma de agua oxigenada al 3% formada en una herida. Imagen de Shutterstock – Chankzs
2. Otra función empleada en el campo de la salud es la antiséptica. La diferencia con el desinfectante viene dada por la concentración de la sustancia. El más concentrado puede dañar los tejidos, mientras que el segundo es respetuoso y no compromete su integridad, ni es absorbido por la piel. Además, son sustancias que actúan rápido y atacan a multitud de bacterias, hongos y virus, pero dada su baja concentración no se emplean en superficies, instrumentos médicos, etc.
3. En la industria de alimentos al 6% reduce la contaminación microbiana externa de las materias primas alimentarias mínimamente procesadas, pero también para desinfectar los materiales laminados compuestos que se emplean para formar los envases antes del llenado aséptico.
4. Existen, a su vez, otras aplicaciones alejados de la salud y la higiene: En tecnología aeroespacial, por ejemplo, se utiliza con una concentración del 90% como comburente o como propelente ecológico. Ha cobrado, además, mayor protagonismo en la última década dentro de los propulsores verdes de alta energía más prometedores por su bajo precio, versatilidad y baja toxicidad.
Se emplea, por lo tanto, desde la década de 1930 como combustible en cohetes, como propelente para generar gases de accionamiento de turbinas, en sistemas bipropelentes (con dos componentes, combustible y oxidante) y en los de Control de Reacción (RCS) de los aviones espaciales estadounidenses X-1 y X-15, así como las naves espaciales tripuladas Mercury y Gemini.

Diagrama de la cápsula Gemini de NASA History Office
6. Se trata de un compuesto químico oxidante, es decir, cambia su estado de oxidación al aceptar electrones de otra sustancia durante una reacción química de tipo redox. Esta propiedad la hace muy útil para decolorar fibras, prendas de ropa y telas a concentraciones del 50%, ya que destruye o modifica la molécula del pigmento y del tinte, lo que provoca que el color desaparezca. Cerca del 60% de la producción mundial se emplea para blanqueo de papel y pulpa. También en la industria electrónica es útil para el grabado de circuitos integrados y en la preparación de otros peróxidos en la industria química, como los blanqueantes de detergentes para la ropa, que contienen percarbonato de sodio o perborato de sodio.
7. Su capacidad blanqueante, asimismo, se aprovecha en las peluquerías para la decoloración del cabello con una concentración más suave, del 3 al 15% (10 a 50 volúmenes). La estructura del cabello tiene varias capas (cutícula, corteza y médula), por lo que la pérdida de color se consigue al alcanzar las capas más internas que almacenan los pigmentos característicos del color natural. Es necesario, para ello, una agresión profunda, que consiste en alterar la llamada cutícula, destruir el pigmento natural localizado en la corteza y la médula y añadir, en último lugar, el tinte de manera superficial.
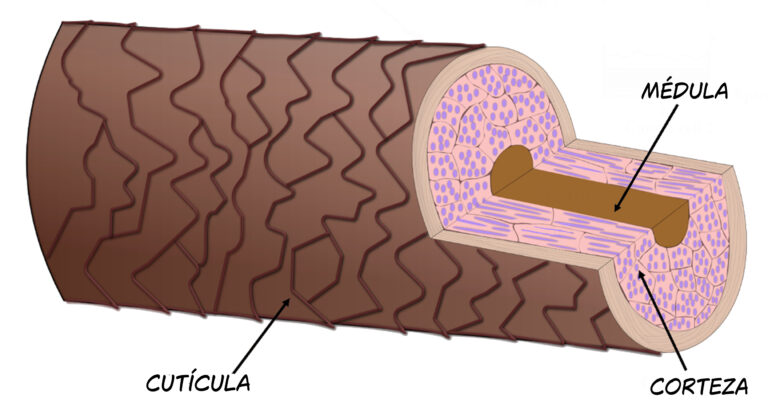
El pelo es una estructura compleja conformada principalmente por tres capas. La cutícula está compuesta por varias capas de células muertas y es en las otras dos donde aparecen las melaninas responsables del color. Tomado de M. H. Philipsen
El agua oxigenada es, por tanto, una sustancia versátil que la convierte en un recurso imprescindible en múltiples usos domésticos e industriales. Es además apreciable como sustancia poco contaminante ya que genera residuos ‘verdes’ al producir agua y oxígeno en su descomposición, por lo que resulta interesante en la actualidad frente a otros compuestos químicos como recurso sostenible.
Bibliografía
Imagen de portada adaptada de Istockphoto de RHJ
Revista Educación Química de Elsevier. Imagen de Thenard
González Bosoquet, L. (2003). Antisépticos y desinfectantes. Offarm, 22(3), 64–70.
Universidad de Vigo. Atlas de histología vegetal y animal
Imagen Catalasa de Jensen, Mikkel Juul
https://www.science-photo.de/bilder/11710749-Action-of-catalase-on-hydrogen-peroxide
Imagen de acción de catalasa en Staphylococos aureus. Sociedad española de microbiología.
Catalasa de la Protein Data Bank
Agency for Toxic Substances and Disease
NASA, diagrama de la nave Gemini
Contenido relacionado
 Descomposición del agua oxigenada
Descomposición del agua oxigenada
Experimento casero de química sobre reacciones químicas y catalizadores realizado con agua oxigenada y sangre.
 ¿Cómo funcionan los tintes para el pelo?
¿Cómo funcionan los tintes para el pelo?
La forma más común de tinte capilar es un proceso en dos etapas, en primer lugar la decoloración […]
 ¿Qué es el poder enzimático?¿Qué tipo de enzimas existen?
¿Qué es el poder enzimático?¿Qué tipo de enzimas existen?
El poder enzimático que anuncian algunos jabones se debe a que contienen enzimas. Cuando hablan del poder enzimático […]
 ¿Qué son los equilibrios redox y cómo se ajustan?
¿Qué son los equilibrios redox y cómo se ajustan?
Reacción redox es sinónimo de reacción de oxidación-reducción. ‘Oxidación’ significa que una especie química pierde electrones y ‘reducción’ […]
 ¿Cómo se nombran los óxidos inorgánicos?
Los óxidos inorgánicos son combinaciones binarias del oxígeno (O) con otro elemento. En la nomenclatura más simple (estequiométrica), basada en la composición, se indican las proporciones de los elementos integrantes.
¿Cómo se nombran los óxidos inorgánicos?
Los óxidos inorgánicos son combinaciones binarias del oxígeno (O) con otro elemento. En la nomenclatura más simple (estequiométrica), basada en la composición, se indican las proporciones de los elementos integrantes.  ¿Puede la corriente eléctrica provocar una reacción?
La electrólisis es una técnica química muy importante que emplea corriente eléctrica para provocar una reacción de oxidación-reducción no espontáneo, al contrario de lo que ocurren en una pila.
¿Puede la corriente eléctrica provocar una reacción?
La electrólisis es una técnica química muy importante que emplea corriente eléctrica para provocar una reacción de oxidación-reducción no espontáneo, al contrario de lo que ocurren en una pila.  La química y la revolución quirúrgica
A lo largo del siglo XIX la cirugía, en gran medida gracias a la química, encontró soluciones para los problemas que desde sus orígenes debía afrontar: el dolor, la infección y la hemorragia. La superación de estas tres barreras es lo que conocemos como revolución quirúrgica.
La química y la revolución quirúrgica
A lo largo del siglo XIX la cirugía, en gran medida gracias a la química, encontró soluciones para los problemas que desde sus orígenes debía afrontar: el dolor, la infección y la hemorragia. La superación de estas tres barreras es lo que conocemos como revolución quirúrgica.  ¿Por qué tiene cloro el agua del grifo?
¿Por qué tiene cloro el agua del grifo?
El agua del grifo tiene cloro para hacerla apta para consumo humano, es decir, ‘potable’. En la potabilización […]
 Un proyecto de ciencia ciudadana mide los metales en los suelos de huertos urbanos de Sevilla y aporta estrategias para rebajarlos
La iniciativa ‘Planta Bienestar’ liderada por estudiantes del IES Híspalis de la capital ha aplicado esta metodología -con la que el conocimiento científico se produce por la participación activa de la ciudadanía- al análisis el plomo presente en las parcelas de cultivo ecológico del Parque de Miraflores. El conocimiento adquirido en esta iniciativa, enmarcada en el programa ‘Andalucía, mejor con ciencia’, se ha trasladado esta mañana a los hortelanos de la asociación del Huerto Urbano de Miraflores que han participado de forma activa en el proyecto junto con la Fundación Descubre y la Diputación de Sevilla.
Un proyecto de ciencia ciudadana mide los metales en los suelos de huertos urbanos de Sevilla y aporta estrategias para rebajarlos
La iniciativa ‘Planta Bienestar’ liderada por estudiantes del IES Híspalis de la capital ha aplicado esta metodología -con la que el conocimiento científico se produce por la participación activa de la ciudadanía- al análisis el plomo presente en las parcelas de cultivo ecológico del Parque de Miraflores. El conocimiento adquirido en esta iniciativa, enmarcada en el programa ‘Andalucía, mejor con ciencia’, se ha trasladado esta mañana a los hortelanos de la asociación del Huerto Urbano de Miraflores que han participado de forma activa en el proyecto junto con la Fundación Descubre y la Diputación de Sevilla.  Identifican componentes bacterianos con función protectora en las plantas de aguacate
Un equipo de investigadores del Instituto de Hortofruticultura Subtropical y Mediterránea ‘La Mayora’ (CSIC-Universidad de Málaga) ha definido qué componentes intervienen en la formación de estas películas naturales y en la adhesión inicial a la raíz de aguacate. Estos compuestos los usa la bacteria 'Pseudomonas chlororaphis' para proteger a la planta del agente causal de la podredumbre blanca radicular del aguacate, el hongo 'Rosellinia necatrix'.
Identifican componentes bacterianos con función protectora en las plantas de aguacate
Un equipo de investigadores del Instituto de Hortofruticultura Subtropical y Mediterránea ‘La Mayora’ (CSIC-Universidad de Málaga) ha definido qué componentes intervienen en la formación de estas películas naturales y en la adhesión inicial a la raíz de aguacate. Estos compuestos los usa la bacteria 'Pseudomonas chlororaphis' para proteger a la planta del agente causal de la podredumbre blanca radicular del aguacate, el hongo 'Rosellinia necatrix'.  Reacciones luminiscentes
Reacciones luminiscentes
La luminiscencia, también conocida como “luz fría”, es un fenómeno que ha llamado la atención del hombre a […]
 La lejía
La lejía
La lejía aparece como tal cuando Claude Louis Berthollet, en 1785, hizo pasar cloro a través de potasa […]
 El papel de la química en los Objetivos de Desarrollo Sostenible
La Agenda 2030 para el Desarrollo Sostenible es un reto sin precedentes, centrado en el cuidado del planeta y sus habitantes. Entre sus objetivos están poner fin a la pobreza, reducir la desigualdad y luchar contra el cambio climático y la desertificación, dentro del respeto a la dignidad humana, la igualdad y la solidaridad. En este planteamiento, la química tiene mucho que aportar y el portal Clickmica ha planteado esta sección para dar a conocer las aplicaciones y descubrimientos de la disciplina relacionadas con este plan de acción de la ONU.
El papel de la química en los Objetivos de Desarrollo Sostenible
La Agenda 2030 para el Desarrollo Sostenible es un reto sin precedentes, centrado en el cuidado del planeta y sus habitantes. Entre sus objetivos están poner fin a la pobreza, reducir la desigualdad y luchar contra el cambio climático y la desertificación, dentro del respeto a la dignidad humana, la igualdad y la solidaridad. En este planteamiento, la química tiene mucho que aportar y el portal Clickmica ha planteado esta sección para dar a conocer las aplicaciones y descubrimientos de la disciplina relacionadas con este plan de acción de la ONU.  ¿Se han descubierto muchos productos químicos por casualidad?
¿Se han descubierto muchos productos químicos por casualidad?
Si «por casualidad» entendemos que buscando obtener una sustancia se forma otra diferente y se investiga su composición, propiedades […]
 Vitamina C
La vitamina C, también conocida ácido ascórbico, es un antioxidante que favorece la absorción del hierro y los procesos de cicatrización.
Vitamina C
La vitamina C, también conocida ácido ascórbico, es un antioxidante que favorece la absorción del hierro y los procesos de cicatrización.  Desarrollan un método rápido y sostenible para evaluar la capacidad antioxidante de la nuez
Un equipo de investigación de la Universidad de Cádiz ha diseñado una metodología alternativa para medir la calidad de este fruto seco disminuyendo los tiempos de análisis con disolventes sostenibles. Tras obtener unos resultados óptimos, los expertos estudian ahora si esta técnica pudiera ser extrapolable a pistachos y almendras.
Desarrollan un método rápido y sostenible para evaluar la capacidad antioxidante de la nuez
Un equipo de investigación de la Universidad de Cádiz ha diseñado una metodología alternativa para medir la calidad de este fruto seco disminuyendo los tiempos de análisis con disolventes sostenibles. Tras obtener unos resultados óptimos, los expertos estudian ahora si esta técnica pudiera ser extrapolable a pistachos y almendras.  Química Vs. Alquimia. El sueño del alquimista
Reproducir en el laboratorio algunos de los experimentos que Harry Potter hace en sus novelas es más fácil gracias al trabajo de un grupo de alumnas de 4º de ESO del colegio La Inmaculada de Algeciras (Cádiz).
Química Vs. Alquimia. El sueño del alquimista
Reproducir en el laboratorio algunos de los experimentos que Harry Potter hace en sus novelas es más fácil gracias al trabajo de un grupo de alumnas de 4º de ESO del colegio La Inmaculada de Algeciras (Cádiz).  La Superespuma
La superespuma es una experiencia basada en la descomposición catalítica del peróxido de hidrógeno o agua oxigenada.
La Superespuma
La superespuma es una experiencia basada en la descomposición catalítica del peróxido de hidrógeno o agua oxigenada. 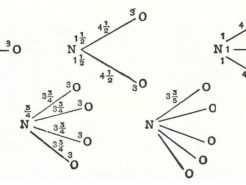 ¿En qué proporciones se unen unos elementos con otros?
¿En qué proporciones se unen unos elementos con otros?
Los elementos químicos se unen en función de sus ‘valencias’ tomando como referencia el hidrógeno. Esto quiere decir que un elemento puede […]
 ¿Todas las sustancias que tienen la misma fórmula son iguales?
¿Todas las sustancias que tienen la misma fórmula son iguales?
No, las fórmulas abreviadas o empíricas solamente indican qué elementos están presentes en un compuesto y cuáles son […]
 ¿Qué se necesita para que se produzca el fuego?
¿Qué se necesita para que se produzca el fuego?
En principio se estableció que eran necesarios tres factores conocidos como ‘triángulo del fuego’ para que éste se […]
 ¿Cómo se forman los enlaces químicos?
¿Cómo se forman los enlaces químicos?
Los enlaces químicos se forman ganando, cediendo o compartiendo electrones para alcanzar configuraciones electrónicas estables como por ejemplo […]
 La formulación química
La formulación química
Fue el químico sueco Jöns Jacob Berzelius quien, en 1813, sentó las bases del actual sistema de formulación química. […]
 Ley de Proust o Ley de las proporciones definidas
Ley de Proust o Ley de las proporciones definidas
La ley de Proust, una de las leyes fundamentales de la química, fue enunciada en 1801 para dar […]
 La teoría atómica: Átomos y moléculas, elementos y compuestos
¿De qué está hecho el mundo que nos rodea? La teoría atómica es la teoría científica que afirma que la materia está compuesta de unidades discretas denominadas átomos, la cual ha ido cambiando a lo largo del tiempo al incorporar las nuevas evidencias experimentales.
La teoría atómica: Átomos y moléculas, elementos y compuestos
¿De qué está hecho el mundo que nos rodea? La teoría atómica es la teoría científica que afirma que la materia está compuesta de unidades discretas denominadas átomos, la cual ha ido cambiando a lo largo del tiempo al incorporar las nuevas evidencias experimentales. 


