¿Qué es un mol?

El mol es una magnitud que indica la cantidad de una sustancia en el Sistema Internacional de unidades (SI)
Antes de nada debes entender el concepto de magnitud, que no es otra cosa que todo lo que se puede medir de alguna manera y se puede representar con un número. Esto permite que se pueda estudiar en las ciencias experimentales, es decir, en las ciencias que necesitamos observar, medir, como ocurre con el tamaño, el volumen, la velocidad o la cantidad de materia. Las magnitudes son, por tanto, propiedades de las cosas que se pueden medir y tienen asociada una unidad. En el caso del mol se relaciona con la masa de las sustancias a pequeña escala, por lo tanto guarda relación con los gramos de los átomos y las moléculas (masa atómica y masa molecular respectivamente). Además, se puede conocer cuántas partículas hay en una cantidad determinada de moles gracias al número de Avogadro, con el que también se le puede relacionar.

Hierro y agua
Esto significa que podemos contar cuántos átomos o moléculas hay en una cantidad de alguna sustancia, por ejemplo en un tornillo de hierro o en un vaso de agua, a partir de su masa, dado que nadie trabaja con, por ejemplo, un átomo de hierro o dos moléculas de agua. Su definición es la “cantidad de sustancia que contiene tantas partículas (átomos, moléculas, iones, etc.) como existen en 12 g del isótopo de carbono 12. Aunque puede sonar confuso al principio, es un concepto sencillo de manejar.
El mol se emplea en las reacciones químicas
Es utilizado para calcular la masa de los componentes de la reacción y permite conocer también el número de moléculas y átomos que hay en esa masa: primero se calcula la masa molecular sumando las masas atómicas de cada elemento participante, multiplicada por el número de veces que aparece, y el número resultante se expresa en gramos. Veamos la reacción:
CaCO3 → CaO + CO2
1 mol de CaCO3 (100 g) origina 1 mol de CaO (56 g) más 1 mol de CO2 (44 g), cumpliéndose la Ley de la conservación de la materia.
La cantidad de moléculas (o átomos) que hay en un mol lo describe el número de Avogadro y es de 6,02·1023. Esto es equivalente a que si, por ejemplo, tenemos una docena de huevos y conocemos la masa de cada uno, podemos relacionar la cantidad de huevos y la masa total.
Un mol de huevos y un mol de agua
Para entender el porqué de emplear el concepto de mol para las partículas del tamaño de átomos y moléculas podemos observar las masas de sus componentes: En la molécula de agua, si sumamos la masa de todos los protones, neutrones y electrones que la conforman, se obtiene 3·10-26 Kg, es decir, es extremadamente pequeña. Un huevo, en cambio, tiene una masa aproximada de 50 g, por lo que la docena de huevos será de unos 0,6 Kg en comparación con la docena de moléculas de agua, 3,6·10-25 Kg.
Como puedes ver, seguimos teniendo problemas para manejarnos con esto en un laboratorio y por lo tanto necesitamos acudir al concepto de mol. Pero, ¿qué ocurre en el caso de los huevos? Podemos calcularlo y comparar con el agua:
Según el número de Avogadro, 1 mol de moléculas de agua contiene 6,02·1023 moléculas, y esa cantidad de moles para el agua corresponde a una masa molecular de 18g. Esto significa que esa cantidad de moléculas de agua tiene una masa total de 18 g. Es como si las pusiéramos todas juntas en una balanza (realmente es una cantidad muy pequeña, piensa que podrías tomarlo con una jeringa de 20ml)
En el caso de los huevos: un mol tendría la misma cantidad, 6,02·1023 huevos. Esto implicaría una masa total de 3,01·1022 Kg. Ten en cuenta que nuestra luna tiene una masa de 7,35·1022 Kg por lo que podríamos tener un segundo satélite, algo más pequeño que nuestra vecina, orbitando felizmente alrededor de nuestro planeta. ¡Toda una locura esta cantidad desorbitada de huevos!

Un mol de huevos es casi la mitad de la masa de la luna, mientras que un mol de agua son solo 18g (o 18 ml si lo pensamos como volumen de agua).
El mol, por lo tanto, es una unidad de medida ampliamente empleada en la ciencia, para moléculas y átomos dado su pequeño tamaño. Indica masa y también la cantidad, tanto de las moléculas como de los átomos.
¿Sabías que existe un Día del Mol?
Se celebra internacionalmente el 23 de octubre entre las 6:02 am y las 6:02 pm, a la manera que tienen en Estados Unidos, país donde se originó, de expresar las fechas anteponiendo el mes al número del día. Apareció por primera vez en un artículo en la revista The Science Teacher a principios de la década de 1980 a raíz de la motivación de un profesor de química de secundaria para celebrar el día, popularizándose tiempo después y dando lugar a la Fundación Nacional del Día del Mol en dicho país en 1991. En España celebramos además el Día de la Química el 15 de noviembre.
Sabemos que te gusta la química, pero existen otras materias interesantes. Con fundaciondescubre.es puedes estar al día de la actualidad científica de Andalucía.
Si prefieres la ciencia más divulgativa, aquí tienes nuestra revista iDescubre.
Fuentes
https://clickmica.fundaciondescubre.es/recursos/unidades-didacticas/el-mol/
Furió, C., Azcona, R., & Guisasola, J. (2002). The learning and teaching of the concepts ‘amount of substance’ and ‘mole’: A review of the literature. Chemistry Education Research and Practice, 3(3), 277–292. https://doi.org/10.1039/b2rp90023h
https://es.wikipedia.org/wiki/Sistema_Internacional_de_Unidades
https://es.wikipedia.org/wiki/Magnitud_f%C3%ADsica
Wang, Linda (2007). «National Chemistry Week Celebrates 20 Years.» Chemical & Engineering News. 85 (51). https://doi.org/10.1021/cen-v085n051.p036
https://www.quimicaysociedad.org/dia-de-la-quimica/
https://quimica.us.es/noticias/celebracion-de-san-alberto-magno
https://www.nsta.org/science-teacher
Contenido relacionado
 ¿Qué es la masa atómica?
¿Qué es la masa atómica?
Se trata de la masa de un átomo expresada en ‘uma’ o ‘u’ (por sus siglas ‘unidad de […]
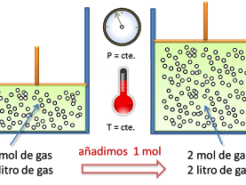 La ley de Avogadro
La ley de Avogadro
El físico italiano Amodeo Avogadro formuló en 1811 la ley de avogadro atraído por el estudio de los gases. La […]
 ¿Existen átomos libres en la naturaleza?
¿Existen átomos libres en la naturaleza?
En la naturaleza solamente los gases nobles y los metales en estado gaseoso están constituidos por átomos aislados. […]
 ¿Por qué el carbono da tantos compuestos distintos?
¿Por qué el carbono da tantos compuestos distintos?
El carbono da multitud de compuestos diferentes porque sus átomos tienen la capacidad de unirse tanto entre sí como con […]
 ¿Con qué nombre se conoce el aumento de volumen a temperatura ambiente de sustancias como el bismuto?
¿Con qué nombre se conoce el aumento de volumen a temperatura ambiente de sustancias como el bismuto?
El bismuto, como otros elementos, tiene la peculiaridad de expandirse cuando solidifica, pero no recibe ningún nombre especial. […]
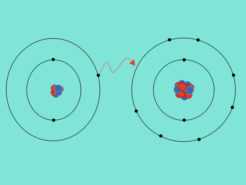 ¿Cómo se forman los enlaces químicos?
¿Cómo se forman los enlaces químicos?
Los enlaces químicos se forman ganando, cediendo o compartiendo electrones para alcanzar configuraciones electrónicas estables como por ejemplo […]
 ¿De qué están hechas las siliconas?
¿De qué están hechas las siliconas?
¿De qué están hechas las siliconas?
¿De qué están hechas las siliconas?  ¿En qué consiste un análisis químico?
La finalidad de un análisis químico es conocer la composición de la muestra que se esté estudiando. A lo largo de los años se han desarrollado muchas técnicas y procedimientos de análisis diferentes. El tipo y número de operaciones que se realicen dependerá del tipo de análisis que necesitemos.
¿En qué consiste un análisis químico?
La finalidad de un análisis químico es conocer la composición de la muestra que se esté estudiando. A lo largo de los años se han desarrollado muchas técnicas y procedimientos de análisis diferentes. El tipo y número de operaciones que se realicen dependerá del tipo de análisis que necesitemos.  ¿De dónde sacan las células animales energía para vivir?
En la mayoría de las células animales ocurre una serie de reacciones químicas en la que se consumen moléculas orgánicas y oxígeno para la liberar energía. Este proceso se conoce como respiración celular aerobia.
¿De dónde sacan las células animales energía para vivir?
En la mayoría de las células animales ocurre una serie de reacciones químicas en la que se consumen moléculas orgánicas y oxígeno para la liberar energía. Este proceso se conoce como respiración celular aerobia.  ¿Qué es la IUPAC?
La Unión Internacional de Química Pura y Aplicada (IUPAC) es una organización internacional fundada en 1919 por químicos del mundo académico e industrial conscientes de la importancia de la estandarización de pesos, medidas, nomenclatura y símbolos en el campo de la Química.
¿Qué es la IUPAC?
La Unión Internacional de Química Pura y Aplicada (IUPAC) es una organización internacional fundada en 1919 por químicos del mundo académico e industrial conscientes de la importancia de la estandarización de pesos, medidas, nomenclatura y símbolos en el campo de la Química.  ¿Qué moléculas se emplean como aromas en perfumes y alimentos?
Distinguimos cinco sabores pero, ¿Cuántos olores hay? ¿Sabías que los ingredientes de los perfumes se encuentran también en la industria alimentaria? Descubre un poco acerca de estos compuestos tan cotidianos.
¿Qué moléculas se emplean como aromas en perfumes y alimentos?
Distinguimos cinco sabores pero, ¿Cuántos olores hay? ¿Sabías que los ingredientes de los perfumes se encuentran también en la industria alimentaria? Descubre un poco acerca de estos compuestos tan cotidianos.  ¿Qué es la tabla periódica?
¿Qué es la tabla periódica?
En 1869, Dmitri Mendeleiév presentó su primera versión de la tabla periódica compuesta por 63 elementos iniciales, convirtiéndose […]
 ¿Qué composición química tiene un aceite?
La mayoría de moléculas que componen los aceites son lípidos. Principalmente triglicéridos (también llamados triacilgliceroles), que son el resultado de la combinación de los tres grupos alcohólicos del glicerol (glicerina) con tres ácidos grasos iguales o distintos.
¿Qué composición química tiene un aceite?
La mayoría de moléculas que componen los aceites son lípidos. Principalmente triglicéridos (también llamados triacilgliceroles), que son el resultado de la combinación de los tres grupos alcohólicos del glicerol (glicerina) con tres ácidos grasos iguales o distintos.  ¿Qué es la química?
¿Qué es la química?
Desde la producción de cosméticos hasta los compuestos que dan sabor a los alimentos o la producción de […]
 Antoine Lavoisier
Antoine Lavoisier
Antoine-Laurent de Lavoisier (París 1743-1794) fue un químico, biólogo y economista francés, considerado el creador de la química […]
 Amodeo Avogadro
Amodeo Avogadro
Amodeo Avogadro (Turín, 1776 -1856) formuló la ley que lleva su nombre por la que consiguió explicar por […]
 ¿Qué son las jaulas moleculares?
Las jaulas moleculares son estructuras moleculares tridimensionales que contiene cavidades en las que retener a otras moléculas en su interior. Juegan un papel muy importante en la administración de fármacos y la producción de productos químicos.
¿Qué son las jaulas moleculares?
Las jaulas moleculares son estructuras moleculares tridimensionales que contiene cavidades en las que retener a otras moléculas en su interior. Juegan un papel muy importante en la administración de fármacos y la producción de productos químicos.  ¿Qué son los fitoquímicos?
Los fitoquímicos son compuestos biológicamente activos producidos por las plantas. Juegan un papel importante en su crecimiento y en los mecanismos de control y defensa ante competidores, patógenos y depredadores, así como en situaciones de stress.
¿Qué son los fitoquímicos?
Los fitoquímicos son compuestos biológicamente activos producidos por las plantas. Juegan un papel importante en su crecimiento y en los mecanismos de control y defensa ante competidores, patógenos y depredadores, así como en situaciones de stress.  ¿Son todos los ácidos y bases igual de fuertes?
Podemos encontrar ácidos y bases con distinta fuerza. Esto permite crear una escala según la cantidad y el tipo de iones presentes en la disolución acuosa.
¿Son todos los ácidos y bases igual de fuertes?
Podemos encontrar ácidos y bases con distinta fuerza. Esto permite crear una escala según la cantidad y el tipo de iones presentes en la disolución acuosa.  ¿Siempre se han llamado igual los compuestos químicos?
A lo largo de la historia, muchos elementos y, sobre todo, compuestos químicos han recibido diferentes nombres. Hoy en día se recomienda aplicar una nomenclatura especialmente diseñada y reconocida internacionalmente.
¿Siempre se han llamado igual los compuestos químicos?
A lo largo de la historia, muchos elementos y, sobre todo, compuestos químicos han recibido diferentes nombres. Hoy en día se recomienda aplicar una nomenclatura especialmente diseñada y reconocida internacionalmente.  Analizan un compuesto orgánico con influencia en el cambio climático
Analizan un compuesto orgánico con influencia en el cambio climático
El óxido de limoneno se caracteriza por ser un producto de degradación del propio limoneno, el componente químico […]
 ¿Qué son los mensajeros químicos?
Los mensajeros químicos son sustancias que permiten la comunicación entre las células, de forma que una vez liberados, generan una respuesta en la célula receptora. Se clasifican en hormonas, neurotrasmisores y sustancias autacoides.
¿Qué son los mensajeros químicos?
Los mensajeros químicos son sustancias que permiten la comunicación entre las células, de forma que una vez liberados, generan una respuesta en la célula receptora. Se clasifican en hormonas, neurotrasmisores y sustancias autacoides.  Análogos químicos de una molécula obtenida de una fuente marina demuestran ser efectivos frente al cáncer de pulmón
Investigadores del Instituto de Investigación Biosanitaria de Granada, la Universidad de Granada y la Universidad de Málaga han generado análogos químicos de la molécula bengamida que han sido altamente efectivos en los primeros ensayos frente al cáncer de pulmón.
Análogos químicos de una molécula obtenida de una fuente marina demuestran ser efectivos frente al cáncer de pulmón
Investigadores del Instituto de Investigación Biosanitaria de Granada, la Universidad de Granada y la Universidad de Málaga han generado análogos químicos de la molécula bengamida que han sido altamente efectivos en los primeros ensayos frente al cáncer de pulmón.  Calcio
Este elemento, de número atómico 20, es el quinto elemento más abundante en la corteza terrestre, y se presenta ampliamente como carbonato de calcio, comúnmente conocido como piedra caliza. También es el quinto ion disuelto más abundante en el agua de mar. El humano promedio contiene aproximadamente 1 kg de calcio, de los cuales el 99% se almacena en nuestros huesos.
Calcio
Este elemento, de número atómico 20, es el quinto elemento más abundante en la corteza terrestre, y se presenta ampliamente como carbonato de calcio, comúnmente conocido como piedra caliza. También es el quinto ion disuelto más abundante en el agua de mar. El humano promedio contiene aproximadamente 1 kg de calcio, de los cuales el 99% se almacena en nuestros huesos.  Cloro
El cloro es un gas tóxico amarillo-verdoso aislado por primera vez por Carl Wilhem Scheele en 1774, aunque será Humphry Davy en 1810 quien demostrará que es un elemento y le asignará su nombre (Khlôros en griego significa verde pálido).
Cloro
El cloro es un gas tóxico amarillo-verdoso aislado por primera vez por Carl Wilhem Scheele en 1774, aunque será Humphry Davy en 1810 quien demostrará que es un elemento y le asignará su nombre (Khlôros en griego significa verde pálido).  Berilio
Berilio
El berilio es un metal gris plateado, duro y ligero de número atómico 4. Fue aislado en 1828 […]
 Azufre
El azufre es un elemento químico, clasificado dentro del grupo de los no metales, se encuentra de manera abundante en la naturaleza. Inodoro en su forma elemental, sus compuestos son bastante hediondos destacando el característico olor a huevos podridos del ácido sulfhídrico.
Azufre
El azufre es un elemento químico, clasificado dentro del grupo de los no metales, se encuentra de manera abundante en la naturaleza. Inodoro en su forma elemental, sus compuestos son bastante hediondos destacando el característico olor a huevos podridos del ácido sulfhídrico.  Cobre
El cobre fue uno de los primeros metales utilizados por el ser humano en la prehistoria y actualmente es el tercero más demandado en el mundo, debido en parte, a su gran conductividad térmica y eléctrica.
Cobre
El cobre fue uno de los primeros metales utilizados por el ser humano en la prehistoria y actualmente es el tercero más demandado en el mundo, debido en parte, a su gran conductividad térmica y eléctrica.  Cromo
Cromo
El cromo es un elemento metálico de número atómico 24. Es duro, frágil y de color plateado. Fue […]
 Jöns Jacob Berzelius
Jöns Jacob Berzelius (Östergötland, 1779 - Estocolmo, 1848) fue un químico sueco que ideó el moderno sistema de notación química.
Jöns Jacob Berzelius
Jöns Jacob Berzelius (Östergötland, 1779 - Estocolmo, 1848) fue un químico sueco que ideó el moderno sistema de notación química.  La formulación química
La formulación química
Fue el químico sueco Jöns Jacob Berzelius quien, en 1813, sentó las bases del actual sistema de formulación química. […]
 Ley de la Conservación de la Materia
Postula que la cantidad de materia antes y después de una transformación es siempre la misma. Es una de las leyes fundamentales en todas las ciencias naturales. Se resumen con la célebre frase: "nada se pierde, nada se crea, todo se transforma".
Ley de la Conservación de la Materia
Postula que la cantidad de materia antes y después de una transformación es siempre la misma. Es una de las leyes fundamentales en todas las ciencias naturales. Se resumen con la célebre frase: "nada se pierde, nada se crea, todo se transforma".  El carbono
Elemento esencial para la vida. Sus propiedades químicas le permiten formar enlaces con sigo mismo y con otros muchos átomos para formar moléculas complejas que son base de la vida tal y como la conocemos.
El carbono
Elemento esencial para la vida. Sus propiedades químicas le permiten formar enlaces con sigo mismo y con otros muchos átomos para formar moléculas complejas que son base de la vida tal y como la conocemos.  La historia de la tabla periódica hasta el 17 de febrero de 1869
El desarrollo de la tabla periódica es uno de los grandes avances científicos del siglo XIX y que continúa en evolución hasta nuestros días. La idea de que la diversidad química se podía explicar de forma sistemática se asocia fundamentalmente a Dimitri Mendeleev y Lothar Meyer, sin embargo hay muchos más rostros tras esta conquista.
La historia de la tabla periódica hasta el 17 de febrero de 1869
El desarrollo de la tabla periódica es uno de los grandes avances científicos del siglo XIX y que continúa en evolución hasta nuestros días. La idea de que la diversidad química se podía explicar de forma sistemática se asocia fundamentalmente a Dimitri Mendeleev y Lothar Meyer, sin embargo hay muchos más rostros tras esta conquista.  Platino
El platino es un metal precioso muy versátil cuyas aplicaciones van desde la joyería y el material de laboratorio, a los catalizadores de nueva generación pasando por los medicamentos utilizados en el tratamiento del cáncer.
Platino
El platino es un metal precioso muy versátil cuyas aplicaciones van desde la joyería y el material de laboratorio, a los catalizadores de nueva generación pasando por los medicamentos utilizados en el tratamiento del cáncer.  Potasio
El potasio fue el primer metal alcalino aislado por Humphry Davy en 1807 mediante la electrolisis de la potasa fundida.
Potasio
El potasio fue el primer metal alcalino aislado por Humphry Davy en 1807 mediante la electrolisis de la potasa fundida.  Hidrógeno
El hidrógeno es un gas incoloro, inflamable, inodoro e insoluble en agua. A pesar de ser el componente más abundante en el Universo es muy escaso en la atmósfera terrestre ya que al ser tan ligero escapa a la gravedad de nuestro planeta. La mayor parte del hidrógeno terrestre se encuentra en forma de hidrocarburos y de agua.
Hidrógeno
El hidrógeno es un gas incoloro, inflamable, inodoro e insoluble en agua. A pesar de ser el componente más abundante en el Universo es muy escaso en la atmósfera terrestre ya que al ser tan ligero escapa a la gravedad de nuestro planeta. La mayor parte del hidrógeno terrestre se encuentra en forma de hidrocarburos y de agua.  Silicio
El silicio es un elemento químico de tipo metaloide que se presenta en forma amorfa y cristalizada. Es el componente fundamental de los aerolitos y el segundo elemento más abundante en la corteza terrestre.
Silicio
El silicio es un elemento químico de tipo metaloide que se presenta en forma amorfa y cristalizada. Es el componente fundamental de los aerolitos y el segundo elemento más abundante en la corteza terrestre.  Etapas clave en el descubrimiento de los elementos químicos
La última incorporación a la tabla periódica fue el oganesón en 2015, pero el proceso de construcción de la lista de todos los elementos empezó mucho antes de nuestra era.
Etapas clave en el descubrimiento de los elementos químicos
La última incorporación a la tabla periódica fue el oganesón en 2015, pero el proceso de construcción de la lista de todos los elementos empezó mucho antes de nuestra era.  ¿En qué proporciones se unen unos elementos con otros?
¿En qué proporciones se unen unos elementos con otros?
Los elementos químicos se unen en función de sus ‘valencias’ tomando como referencia el hidrógeno. Esto quiere decir que un elemento puede […]
 ¿Cuántos elementos químicos hay?
¿Cuántos elementos químicos hay?
La Unión internacional de Química pura y aplicada (IUPAC) admitió oficialmente a comienzos de 2016 la existencia de 118 […]
 ¿Cómo se pone el nombre a los elementos?
¿Cómo se pone el nombre a los elementos?
Una vez contrastada la existencia de un nuevo elemento por la Unión Internacional de Química pura y aplicada […]
 ¿Cuáles son los colores del hidrógeno?
¿Cuáles son los colores del hidrógeno?
El hidrógeno es un gas incoloro, inflamable, inodoro e insoluble en agua. A pesar de ser el componente más […]
 ¿Cómo es la química de los incendios?
El fuego es química. En concreto, una reacción de oxidación muy violenta y exotérmica.
¿Cómo es la química de los incendios?
El fuego es química. En concreto, una reacción de oxidación muy violenta y exotérmica.  ¿Por qué se oxida el hierro?
Debido a una reacción redox, un tipo de reacción química en la que se intercambian electrones entre los reactivos de forma que cambian sus estados de oxidación.
¿Por qué se oxida el hierro?
Debido a una reacción redox, un tipo de reacción química en la que se intercambian electrones entre los reactivos de forma que cambian sus estados de oxidación.  ¿Qué es el número atómico?
¿Qué es el número atómico?
Atómico significa relativo al átomo, la porción más pequeña en que puede dividirse un elemento químico manteniendo sus […]



