¿Podemos emplear la química para obtener electricidad?
Energía y medio ambiente Reacciones
Química sostenible: Aprendizaje y educación, Producción y consumo responsable

El primer científico que investigó las relaciones entre la electricidad y la bioquímica fue Luigi Galvani, cuando 1971 realizó en Bolonia (Italia) un estudio acerca de las descargas eléctricas de la atmósfera. A partir de esta investigación se desarrollaron otras, en la que se observó un nexo común: la capacidad de la materia para generar reacciones donde hay movimiento de cargas eléctricas.
Desde entonces la electroquímica ha logrado grandes avances, y hoy tiene aplicaciones en áreas tan variadas como el análisis ambiental, la industria alimentaria o la ciencia forense.También está presente, por ejemplo, en el uso de baterías y pilas como alternativa a la producción de energías provenientes de combustibles fósiles.
La rama de la química encargada de estudiar todo esto recibe el nombre de electroquímica. Dentro de las aplicaciones más comunes de estos métodos está, por ejemplo, el análisis clínico, basado en el equilibrio hidroelectrolítico del organismo para su correcto funcionamiento, o el diseño de baterías para smartphones, ordenadores portátiles, etc.
Para entender la relación entre la química y la electricidad primero tendremos que conocer un poco más acerca del descubrimiento de la electricidad y conceptos como oxidación, reducción, voltaje o celda.
¿Qué es la electroquímica?
En 1791, en Bologna (Italia), nace esta disciplina a partir del vínculo de la electricidad y la bioquímica a través de los ensayos realizados por Luigi Galvani. Su estudio acerca de las descargas eléctricas de la atmósfera le hicieron desarrollar el concepto de ‘electricidad animal’ a partir de las observaciones experimentales en ranas. Aunque existen varias versiones acerca del origen del descubrimiento casual, lo cierto es que sirvió de base para sus indagaciones con estos anfibios. Advirtió la aparición de contracciones musculares de las ancas en diferentes pruebas:
- Al tocar la extremidad por medio de un arco bimetálico de cobre y cinc (se establecía un circuito cerrado entre las piezas de metal y el sistema nervioso del animal).
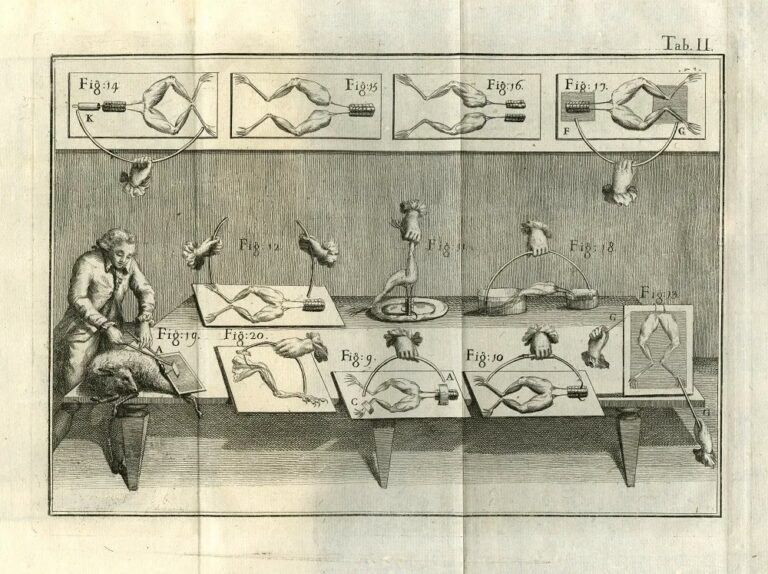
Imagen del libro ‘De viribus electricitatis in motu musculari commentarius, cum J. Aldini dissertatione et notis. Acc. epistolae ad animalis electricitatis theoriam pertinentes’, Luigi Galvani. Fuente: Wellcome Collection
- Al colocar las ancas cerca de máquinas electrostáticas en funcionamiento (dispositivos que generan electricidad estática), mientras estas producían chispas tocaba los nervios del batracio con un bisturí y se observaba el movimiento de la extremidad.
Galvani concluyó que las muestras de rana presentaban un comportamiento similar a un botella de Leyden (una dispositivo que es capaz de almacenar cargas eléctricas a modo de condensador): cada músculo estaba cargado de electricidad positiva en su interior y negativa en el exterior, esto producía un flujo de corriente que provocaba la contracción del anca de manera similar a cómo se produce una descarga en el dispositivo de Leyden cuando en esta la energía eléctrica viaja de un punto al otro.

Máquina electrostática de Galvani a la izquierda y botella de Leyden a la derecha. CC BY-NC-SA 4.0 Licence Grupo ‘Museos de la Ciencia’.
Otra contribución de este científico fue el concepto de ‘Galvanismo’, el cual hace referencia a la generación de corriente eléctrica por el contacto de dos metales diferentes (cinc y cobre, por ejemplo) sumergidos en un medio acuoso o húmedo.
A partir de las investigaciones del científico italiano, se sucedieron diferentes avances como los de Alessandro Volta, quién centró su trabajo en la experimentación con los metales. De este modo, desarrolló un aparato consistente en discos alternados de cobre y zinc separados por fieltros impregnados en salmuera. Este sistema era la ‘pila voltaica’, un gran avance en el que pronto trabajaron otros investigadores como Becquerel, Daniell o Grove.

Pila Voltaica: 85 celdas de tres discos (Cobre, fieltro y zinc), alambre superior de cobre unido a discos de cobre superiores y discos inferiores de zinc unidos al alambre inferior de zinc. Museo de Historia de la Ciencia de la Universidad de Cambridge.
Las reacciones químicas producen electricidad
Los estudios de todos estos científicos mantienen un nexo común: la capacidad de la materia, tanto en la naturaleza como en el laboratorio, para generar reacciones donde hay movimiento de cargas eléctricas. Estas cargas pueden ser iones y otras partículas como los electrones.
Los átomos y los iones tienen la capacidad de atraer electrones hacia ellos, es decir, presentan electronegatividad. El proceso en el que se da el traspaso de estas partículas del menos electronegativo al átomo o ion que más les atrae es una reacción de óxido reducción, también llamada ‘redox’, y en ella los elementos cambian de estado de oxidación. La reacción alcanza un equilibrio donde la energía liberada en la transformación se disipa en forma de calor o de mayor desorden (entropía).
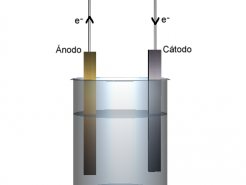
La reacción redox puede separarse en dos semirreacciones, una que libera los electrones (semirreacción de oxidación) y otra que los acepta (semirreacción de oxidación), lo que permite aprovechar el flujo de electrones que se genera para realizar trabajo eléctrico. Las semirreacciones se producen en el ánodo y en el cátodo.
Celdas para estudiar la reacción
Tanto Galvani, como Volta y los demás, trabajaron con ‘celdas electroquímicas’ donde la reacción se produce de manera espontánea. Esto significa que la reacción se va a dar si las condiciones iniciales así lo propician. Pero existen también las celdas electrolíticas: En este otro caso es la aplicación de una fuente de energía externa la que va a generar la reacción en sentido inverso. En este caso es la aplicación de energía eléctrica la que produce una reacción química. Un ejemplo son las pilas recargables.
En las reacciones redox se puede determinar también el ‘voltaje’ del sistema donde tienen lugar. Este término, también llamado ‘fuerza electromotriz’ (fem) de la pila, corresponde a la ‘presión’ de los electrones al desplazarse del ánodo al cátodo en las celdas electroquímicas (las electrolíticas invierten este flujo: los electrones viajan al revés, del cátodo al ánodo).
La electroquímica permite por tanto calcular la fuerza electromotriz de la celda y ver cómo factores como temperatura o presión afectan a la velocidad o la cantidad de cationes presentes en la reacción afectan al voltaje del sistema a través de una ecuación matemática establecida por Walther Nernst en 1889.
La Celda de Daniell
En ambos tipos de celda, la sustancia que cede electrones se oxida y la que los acepta se reduce. Por ejemplo, en el experimento de Daniell, que utiliza una celda galvánica, se emplea una placa de cinc sumergida en una disolución de sulfato de cinc y una placa de cobre en una disolución de sulfato de cobre, conectadas mediante un puente relleno de una disolución salina. Las placas se encuentran, a su vez, conectadas mediante un alambre conductor y una resistencia que mide el voltaje.
En este dispositivo se observa que el zinc metálico se oxida a Zn+2, quedando esta placa desgastada y la disolución con mayor concentración de iones de cinc, y el catión de cobre (II) disuelto se reduce al cobre metálico, el cual se deposita en la superficie de la placa de este elemento, que queda más gruesa, por lo que el proceso finaliza con menos cantidad de iones de este metal al alcanzar el equilibrio de la reacción. Se genera por tanto un flujo de electrones de un metal al otro, disolviendo uno de ellos y depositando material sólido en el otro y un voltaje eléctrico que permite la obtención de energía para su empleo en diferentes dispositivos electrónicos.
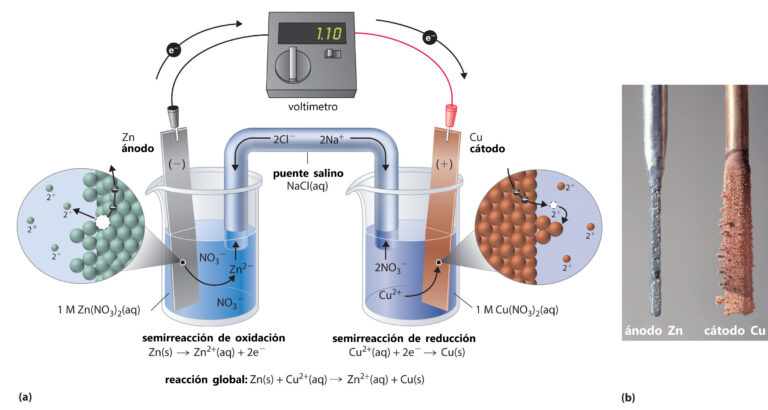
Reacción del zinc metálico con iones de cobre (II) en una celda galvánica. Averill, B., & Eldredge, P. A. (2011). General Chemistry: Principles, Patterns, and applications.
Los animales y la electricidad
Este mecanismo es en realidad el mismo sistema que se crea cuando Galvani conecta el anca de rana y los dos metales. En este caso la extremidad del animal se comporta como la unión salina entre los dos metales de la pinza (las piezas eran cada una de un metal diferente, como ocurrió con las placas del experimento de Daniell). En un organismo hay sales disueltas de manera similar al puente salino, lo que permite conducir electricidad a través de esa disolución. Este circuito cerrado provocaba así el estímulo del nervio de la pata, generando la contracción muscular. Por tanto, el concepto de Galvani de ‘electricidad animal’ se trataba de un proceso electroquímico reproducible también sin partes animales.
No obstante, hoy día se conocen tejidos especializados en los seres vivos que son capaces de generar electricidad. Tal es el caso del tejido del corazón encargado de generar el latido, cuyo trabajo realiza el marcapasos si hay algún problema médico que lo requiera, o casos de ciertos animales como la anguila eléctrica (electrophorus electricus) o la raya eléctrica (narcine bancroftii), en el que sus cuerpos son capaces de generar descargas de cierto voltaje.

Animales capaces de generar electricidad de diversos voltajes para caza y defensa. Izquierda, anguila eléctrica hasta 860 voltios. Imagen David de Santana. Derecha, raya eléctrica, de 14 a 37 voltios.Imagen: Wayne Hoggard
Aplicaciones de la electroquímica
La electricidad que estudiaron estos científicos es generada, por tanto, en las reacciones de óxido reducción y pueden ser observadas desde el comienzo del proceso hasta alcanzar el equilibrio que detiene el flujo de electrones. Esto se realiza mediante técnicas electroanalíticas y tiene aplicación en numerosos campos como por ejemplo:
- El análisis ambiental, donde se encarga del estudio de tóxicos y metales pesados como plomo, cadmio o mercurio, o incluso arsénico en concentraciones tan pequeñas como las ‘trazas’. Se realiza en organismos vegetales y animales, sedimentos y suelos, agua tanto potable como residual, etc. También la detección y cuantificación de contaminantes para el sector agrícola (plaguicidas, herbicidas…) o de nutrientes en agua y suelos.
- La industria alimentaria, para el control de calidad y la seguridad alimentaria basado en la detección de compuestos como riboflavina en marisco, leche en polvo y miel, vainillina y triptófano en chocolate, tiamina en arroz, etc.
- La caracterización de materiales o el análisis del comportamiento de la corrosión en la superficie de metales y aleaciones en contacto, por ejemplo, con agua de mar.
- la industria farmacéutica, la ciencia forense y la biomedicina, para análisis de hormonas en fármacos y orina, determinados compuestos en muestras clínicas como drogas o medicamentos, etc.
Otras aplicaciones de la electroquímica implica el uso de baterías y pilas como alternativa a la producción de energías provenientes de combustibles fósiles gracias al diseño de motores eléctricos. También son empleadas para el almacenamiento energético de fuentes alternativas de energía.
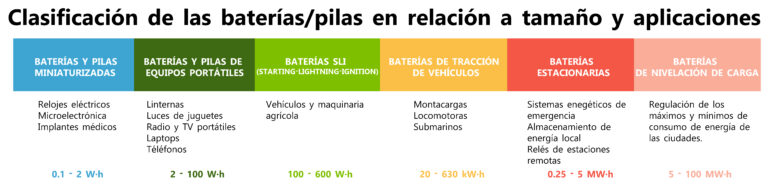
Los dispositivos se pueden ordenar en función de la energía que suministran (De vatios por hora para las más pequeñas a megavatios por hora para los más energéticos). Adaptado de Sanchez Granados, R. L.. Anales de Química de la RSEQ.
Esta ciencia se emplea además para obtención de cloro, empleado en la depuración de aguas, y derivados industriales, como el PVC, en celdas electrolíticas. Esto se consigue mediante la electrólisis de la salmuera de la sal común (NaCl), por lo que se trata de la reacción invertida, donde la electricidad genera una reacción química de interés. Es utilizada en la producción de metales como aluminio y titanio y para la galvanización con metales. Otro uso corresponde a los test de alcoholemia, gracias a la reacción redox del etanol que permite medir el nivel de alcohol en conductores ebrios.
En la naturaleza, además de rayas y anguilas, la generación de energía química en la fotosíntesis de las plantas se considera un proceso electroquímico. Las neuronas, a su vez, son capaces de generar impulsos nerviosos basados en la energía eléctrica generada por el paso de iones de sodio y potasio dentro y fuera de las células.
Importancia de la electroquímica
El vínculo del ser humano con esta ciencia radica en los avances tecnológicos desde su descubrimiento. Se trata de una rama de gran importancia para la industria química en el paso a una energía más verde. Mediante electrólisis del agua se puede obtener hidrógeno, una fuente de energía sostenible, y liberar oxígeno a la atmósfera.
El diseño y desarrollo de baterías, condensadores y otras soluciones de almacenamiento energético también es una aplicación destacable: baterías eléctricas y células fotovoltaicas se cuelan en una sociedad cada vez más concienciada con la necesidad de un futuro más sostenible y limpio.
Referencias
https://www.historiadelamedicina.org/Galvani.html
https://clickmica.fundaciondescubre.es/recursos/interactivos/globos-electricidad-estatica/
https://www.um.es/muvhe/cientifico-naturales/botella-de-leyden-10033/
https://descubrelaenergia.fundaciondescubre.es/sobre-la-energia/energia-electrica/
https://clickmica.fundaciondescubre.es/conoce/nombres-propios/alessandro-volta/
https://clickmica.fundaciondescubre.es/conoce/descubrimientos/la-primera-bateria-quimica/
https://clickmica.fundaciondescubre.es/conoce/100-preguntas-100-respuestas/electrolisis/
https://collections.whipplemuseum.cam.ac.uk/objects/10027/
Dickerson, R. E. (1992). Principios de química. Reverte.
https://clickmica.fundaciondescubre.es/conoce/100-preguntas-100-respuestas/falta-se-una-reaccion/
https://winter.group.shef.ac.uk/webelements/periodicity/eneg_pauling/
Sánchez-Quintana, D., & Yen Ho, S. (2003). Anatomía de los nodos cardíacos y del sistema de conducción específico auriculoventricular. Revista Espanola de Cardiologia, 56(11), 1085–1092. https://doi.org/10.1157/13054255
https://www.floridamuseum.ufl.edu/discover-fish/species-profiles/narcine-bancroftii/
https://medioambiente.jcyl.es/web/es/calidad-ambiental/definiciones-caracteristicas.html
https://clickmica.fundaciondescubre.es/conoce/elementos-quimicos/aluminio/
https://clickmica.fundaciondescubre.es/conoce/elementos-quimicos/titanio/
https://clickmica.fundaciondescubre.es/conoce/elementos-quimicos/sodio/
https://clickmica.fundaciondescubre.es/conoce/elementos-quimicos/potasio/
https://clickmica.fundaciondescubre.es/conoce/elementos-quimicos/el-oxigeno/
https://museovirtual.csic.es/salas/vida/vida10.htm
https://www.ateg.es/la-galvanizacion
Solé, Ricard V.; Manrubia, Susanna C. (1996). ‘15. Neurodinámica’. Orden y caos en sistemas complejos. Edicions UPC.
Nanorobots y electroquímica: la investigación de Bahareh Khezri. (2024, November 25). Diari digital de la URV. https://diaridigital.urv.cat/es/entrevistes/nanorobots-electroquimica-khezri/
Contenido relacionado
 ¿Qué son los equilibrios redox y cómo se ajustan?
¿Qué son los equilibrios redox y cómo se ajustan?
Reacción redox es sinónimo de reacción de oxidación-reducción. ‘Oxidación’ significa que una especie química pierde electrones y ‘reducción’ […]
 ¿Puede la corriente eléctrica provocar una reacción?
La electrólisis es una técnica química muy importante que emplea corriente eléctrica para provocar una reacción de oxidación-reducción no espontáneo, al contrario de lo que ocurren en una pila.
¿Puede la corriente eléctrica provocar una reacción?
La electrólisis es una técnica química muy importante que emplea corriente eléctrica para provocar una reacción de oxidación-reducción no espontáneo, al contrario de lo que ocurren en una pila.  Electrólisis del agua
Electrólisis del agua
La electrólisis del agua fue descubierta por dos químicos ingleses, William Nicholson y Anthony Carlisle. Los descubridores de […]
 ¿Por qué las sales conducen la corriente?
Porque son electrolitos, sustancias que al disolverse en agua permiten el paso de la corriente eléctrica.
¿Por qué las sales conducen la corriente?
Porque son electrolitos, sustancias que al disolverse en agua permiten el paso de la corriente eléctrica.  El pararrayos
El pararrayos
El pararrayos fue inventado en 1752 por el científico estadounidense Benjamin Franklin. Mientras efectuaba una serie de experimentos […]
 Alessandro Volta
Alessandro Volta
Alessandro Volta (Como 1745-Como 1827). Maestro de física en Como, en 1775 inventa un aparato para almacenar y […]
 Electrólisis
Electrólisis
La electrólisis es una técnica que consiste en hacer pasar una corriente eléctrica por una sustancia para provocar […]
 “El hidrógeno verde es la manera ideal de acumular energías renovables”
Lleva años estudiando cómo combatir el cambio climático mediante el almacenamiento de la energía renovable que no aprovechamos. Su contribución ha sido merecedora del Premio a la Investigación “Women For Science”, concedido por la Fundación L’Oréal y la UNESCO.
“El hidrógeno verde es la manera ideal de acumular energías renovables”
Lleva años estudiando cómo combatir el cambio climático mediante el almacenamiento de la energía renovable que no aprovechamos. Su contribución ha sido merecedora del Premio a la Investigación “Women For Science”, concedido por la Fundación L’Oréal y la UNESCO.  Michael Faraday
Michael Faraday
Michael Faraday (Newington Butts 1791-Hampton Court 1867). Eminente físico inglés miembro de una familia muy numerosa y humilde, […]
 Una nueva manera de transferir la energía
Una nueva manera de transferir la energía
Una nueva manera de transferir la energía
Una nueva manera de transferir la energía  Soluciones de la química para reducir el impacto medioambiental de las baterías de los vehículos eléctricos
Para 2050, dos tercios de la población mundial estarán asentados en zonas urbanas. A medida que el mundo continúe urbanizándose, el desarrollo sostenible dependerá cada vez más de la gestión exitosa del crecimiento urbano. No en vano, las ciudades ocupan solo el 3% del territorio, pero representan entre el 60 y el 80% del consumo de energía y generan el 70% de las emisiones de carbono.
Soluciones de la química para reducir el impacto medioambiental de las baterías de los vehículos eléctricos
Para 2050, dos tercios de la población mundial estarán asentados en zonas urbanas. A medida que el mundo continúe urbanizándose, el desarrollo sostenible dependerá cada vez más de la gestión exitosa del crecimiento urbano. No en vano, las ciudades ocupan solo el 3% del territorio, pero representan entre el 60 y el 80% del consumo de energía y generan el 70% de las emisiones de carbono.  Exploran una nueva vía para fabricar baterías de magnesio complementarias al litio
Un grupo de investigación de la Universidad de Córdoba, en colaboración con la Universidad de Xiamen y la Académica de Ciencias de Bulgaria, ha estudiado, a escala de laboratorio, la viabilidad de las baterías de magnesio empleando un nuevo compuesto como cátodo.
Exploran una nueva vía para fabricar baterías de magnesio complementarias al litio
Un grupo de investigación de la Universidad de Córdoba, en colaboración con la Universidad de Xiamen y la Académica de Ciencias de Bulgaria, ha estudiado, a escala de laboratorio, la viabilidad de las baterías de magnesio empleando un nuevo compuesto como cátodo. 


