-
 ¿Qué procesos químicos se producen para formar un fósil?
¿Qué procesos químicos se producen para formar un fósil?
Compuestos y propiedades
¿Sabías que la composición de los fósiles es diferente del organismo inicial? ¿Que hay fósiles de 'oro'? ¿O que estos hallazgos nos permiten comprender los linajes evolutivos y la evolución del clima del planeta? -
 ¿Qué moléculas se emplean como aromas en perfumes y alimentos?
¿Qué moléculas se emplean como aromas en perfumes y alimentos?
Compuestos y propiedades
Distinguimos cinco sabores pero, ¿Cuántos olores hay? ¿Sabías que los ingredientes de los perfumes se encuentran también en la industria alimentaria? Descubre un poco acerca de estos compuestos tan cotidianos. -
 El espumillón y la tabla periódica
El espumillón y la tabla periódica
Curiosidades de la tabla
El espumillón es uno de los elementos decorativos característicos de la Navidad. De origen alemán, consiste en finos hilos metálicos brillantes, sin embargo su composición ha cambiado a lo largo del tiempo. -
 ¿Sabías que la Flor de Pascua es un indicador de pH?
¿Sabías que la Flor de Pascua es un indicador de pH?
Compuestos y propiedades
¿Sabías que la Flor de Pascua es un indicador de pH? -

 ¿Cómo es la química de los incendios?
¿Cómo es la química de los incendios?
Agroquímica
El fuego es química. En concreto, una reacción de oxidación muy violenta y exotérmica. -

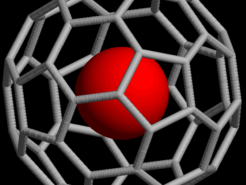 ¿Qué son las jaulas moleculares?
¿Qué son las jaulas moleculares?
Compuestos y propiedades
Las jaulas moleculares son estructuras moleculares tridimensionales que contiene cavidades en las que retener a otras moléculas en su interior. Juegan un papel muy importante en la administración de fármacos y la producción de productos químicos. -

 ¿Qué es el gas licuado?
¿Qué es el gas licuado?
Energía y medio ambiente
El gas licuado del petróleo (GLP) es un combustible que proviene de la mezcla de dos hidrocarburos principales: el propano y butano, aunque también puede contener otros en menor proporción. -

 ¿Qué es el kapton?
¿Qué es el kapton?
Materiales
El telescopio James Webb ha logrado desplegar un escudo térmico del tamaño de una cancha de tenis hecho con 5 capas de Kapton E y con recubrimientos de aluminio y silicio dopado, pero, ¿qué es el kapton? -

 ¿Qué es la acidificación de los océanos?
¿Qué es la acidificación de los océanos?
Energía y medio ambiente
La quema de los diferentes combustibles fósiles, la propia deforestación de los bosques, así como los cambios en el uso del suelo forestal a uso agrícola producen dióxido de carbono CO2 que es emitido a la atmósfera. Este gas, además de contribuir al efecto invernadero, tiene otras consecuencias negativas, ya que afecta a la vida de muchos animales marinos. -

 ¿Cuáles son los colores del hidrógeno?
¿Cuáles son los colores del hidrógeno?
Energía y medio ambiente
El hidrógeno es un gas incoloro, inflamable, inodoro e insoluble en agua. A pesar de ser el componente más […]
-
 ¿Por qué se echa sal en las carreteras cuando nieva?
¿Por qué se echa sal en las carreteras cuando nieva?
Limpieza e higiene
Cuando nieva o hiela los equipos de mantenimiento de carreteras arrojan sal en la carretera para evitar la formación de hielo o para fundir el que se haya podido formar. -

 ¿Se puede obtener gas combustible a partir de residuos orgánicos?
¿Se puede obtener gas combustible a partir de residuos orgánicos?
Energía y medio ambiente
El biogás es un gas combustible cuyos principales componentes son metano y , dióxido de carbono , pudiendo encontrarse además otros componentes en menor proporción.



