Reacción del arcoíris químico

Para introducir la diferencia entre sustancias ácidas y básicas se pueden realizar experiencias en las que se emplean distintos indicadores, creando un arcoiris químico.
Los indicadores tienen la ventaja de ser sustancias que producen reacciones muy vistosas y coloridas que se pueden emplear como pretexto para la introducción de conceptos abstractos como puede ser el de pH.
El concepto de “ácido” suele ser conocido porque todos hemos experimentado alguna vez el sabor de sustancias ácidas como el jugo de limón, aunque a veces se suele relacionar con sustancias corrosivas o peligrosas. Las disoluciones “neutras” muchos las suelen asociar a sustancias inocuas o “naturales”. No se tiene tan claro el concepto de sustancia básica y, en general, cuesta trabajo presentar algún ejemplo.
La idea que se suele tener sobre el pH suele ser confusa y muchas veces equivocada. Una parte de la culpa la tienen los medios de comunicación, donde se habla del pH como un tecnicismo, presentándose productos con pH 5,5 como el pH “natural” para hacer ver que hay mucha ciencia detrás de ellos. Otra parte la tenemos los profesores como consecuencia del excesivo enfoque matemático en el que se incurre con frecuencia, presentando el pH como una mera fórmula: pH = –log [H3O+].
El pH es una magnitud cuantitativa, un valor numérico; es decir, las disoluciones no tienen pH ácidos, básicos o neutros sino que las disoluciones con valores del pH > 7 son básicas, las que tienen valores del pH < 7 son ácidas y para una disolución neutra o para el agua pura, a 25 ºC, el pH = 7.
En el Centro Principia normalmente se presenta a los alumnos y al público de Principia en general, la experiencia del “arcoíris químico” de forma recreativa. Se muestran dos jarras: una de ellas con agua “normal” y la otra con “agua del arcoíris”. Al añadir agua de la primera de ellas a las copas “vacías” no ocurre nada extraño y el agua permanece incolora, pero al añadir “agua del arcoíris” comienzan a aparecer colores como se aprecia en la figura, con lo que se crea un conflicto entre la explicación que se les está dando (agua del arcoíris) y lo que observan. De esta manera las preguntas surgen de manera espontánea y, dependiendo del nivel de los alumnos, se puede hablar en mayor o menor profundidad de los conceptos de ácido, base, neutralización y pH, y cómo pueden afectar a las reacciones químicas.

Procedimiento experimental
Se dispone de dos jarras de agua transparentes de un litro: una de ellas llena de agua (no importa si es del grifo) y la otra con una disolución de hidróxido de sodio (NaOH) 0,05 M (10 g en 5 litros) y siete copas o vasos transparentes en los que se vierten varias gotas de indicadores preparados como se indica a continuación:
Se parte de tres disoluciones de indicadores que se preparan del siguiente modo:
- Fenolftaleína: 1 gramo + 60 ml de alcohol 96º + 40 ml agua destilada
- Timolftaleína: 0,1 gramos + 60 ml de alcohol 96º + 40 ml agua destilada
- p-nitrofenol: 2 gramos + 60 ml de alcohol 96º + 40 ml agua destilada
Para obtener los diferentes colores, se mezclan estas disoluciones de los indicadores en las proporciones (expresadas en volúmenes) que se indican a continuación:
- ROJO: 5 fenolf/ 2 nitrof
- NARANJA: 1 fenolf/ 7 nitrof
- AMARILLO: nitrofenol
- VERDE: 3 timolf/ 5 nitrof
- AZUL: timolftaleína
- AÑIL: 1 fenolf/ 1 timolf
- VIOLETA: fenolftaleína
Una vez preparadas las disoluciones se colocan las siete copas y se añaden las cantidades que se muestran en el siguiente esquema:
| 1ª | 2ª | 3ª | 4ª | 5ª | 6ª | 7ª |
|
1 ml de rojo + 2 gotas de H2SO42,5M |
1 ml de naranja + 2 gotas de H2SO42,5M |
2 gotas de amarillo + 2 gotas de H2SO42,5M |
1 ml de verde + 2 gotas de H2SO42,5M |
1 ml de azul |
1 ml de añil |
5 gotas de violeta |
Se añade a cada copa unos 100 ml de agua (media copa) de la primera jarra (no aparece color en ninguna) y a continuación otros 100 ml de la segunda, que contiene la disolución de NaOH 0,05 M (aparecen los “colores del arcoíris” como se muestra en la fig 1). Por ultimo, se vierten todas las copas en un vaso transparente grande de un litro en el que se han añadido 10 ml de ácido sulfúrico (H2SO4) 2,5M para decolorarlas.
Esta experiencia suele tener gran aceptación ya que es muy vistosa por los colores que aparecen. La solemos presentar sin explicar que se trata de reacciones químicas, de manera que sean los propios alumnos los que nos pregunten por lo que ocurre realmente, con lo que es más fácil introducir los conceptos de reacción y pH ya que están muy motivados.
Contenido relacionado
 ¿Cómo se puede medir la acidez o la alcalinidad de un producto?
Acidez o alcalinidad es la capacidad de una sustancia para aumentar o disminuir la concentración de protones libres en agua. Se pueden medir a través del pH, cuya escala va de 0 a 14. Por debajo de 7 unidades, las disoluciones son ácidas y por encima de ese valor, básicas.
¿Cómo se puede medir la acidez o la alcalinidad de un producto?
Acidez o alcalinidad es la capacidad de una sustancia para aumentar o disminuir la concentración de protones libres en agua. Se pueden medir a través del pH, cuya escala va de 0 a 14. Por debajo de 7 unidades, las disoluciones son ácidas y por encima de ese valor, básicas. 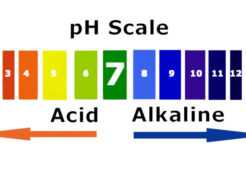 ¿Cómo se mide el pH?
¿Cómo se mide el pH?
Una de las maneras más sencillas para determinarlo consiste en utilizar sustancias indicadoras que cambian de color (viran) […]
 ¿Son todos los ácidos y bases igual de fuertes?
Podemos encontrar ácidos y bases con distinta fuerza. Esto permite crear una escala según la cantidad y el tipo de iones presentes en la disolución acuosa.
¿Son todos los ácidos y bases igual de fuertes?
Podemos encontrar ácidos y bases con distinta fuerza. Esto permite crear una escala según la cantidad y el tipo de iones presentes en la disolución acuosa. 


