La regla del octeto
Gilbert N. Lewis postuló en 1916 la regla del octeto, por la que se establece que la tendencia de los iones de los elementos es completar sus últimos niveles de energía con una cantidad de 8 electrones.
Lewis enunció la regla del octeto al observar la manera en que se combinan entre sí los elementos. Así, advirtió que todos intentan lograr la configuración estructural del gas noble que tienen más cerca en la tabla periódica.
En definitiva, indica que dos átomos iguales, al enlazarse, desarrollan una organización específica. Al constituirse el enlace por la compartición de los pares de electrones, cada átomo adquiere la estructura de un gas noble. Así, ambos átomos se encontrarán rodeados de ocho electrones en su última capa energética.
Esta regla presenta numerosas excepciones, pero sirve para predecir el comportamiento de muchas sustancias. Concretamente, quedan exceptuados el oxígeno, el hidrógeno, el nitrógeno, el carbono, el aluminio, el berilio, el boro, el flúor, el fósforo y el azufre que se organizan de manera diferente para conseguir la estabilidad en sus compuestos.
Este bioquímico norteamericano describió también en el año 1926 el fotón. Este término se refiere a la menor unidad de energía que se produce, se transmite y se absorbe.
Contenido relacionado
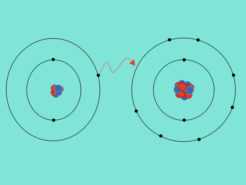 ¿Cómo se forman los enlaces químicos?
¿Cómo se forman los enlaces químicos?
Los enlaces químicos se forman ganando, cediendo o compartiendo electrones para alcanzar configuraciones electrónicas estables como por ejemplo […]
 ¿En qué proporciones se unen unos elementos con otros?
¿En qué proporciones se unen unos elementos con otros?
Los elementos químicos se unen en función de sus ‘valencias’ tomando como referencia el hidrógeno. Esto quiere decir que un elemento puede […]
 ¿Qué es la masa atómica?
¿Qué es la masa atómica?
Se trata de la masa de un átomo expresada en ‘uma’ o ‘u’ (por sus siglas ‘unidad de […]
 Los gases nobles
Los gases nobles
En 1904, Rayleigh y Ramsay recibieron el premio Nobel de Física y Química, respectivamente, por el descubrimiento de […]
 Modelo atómico de Böhr
Modelo atómico de Böhr
Lleva el nombre del físico danés Niels Böhr, quien elaboró en 1913 el primer modelo atómico. El modelo […]



