La paradoja de Levinthal
En términos científicos podemos definir la paradoja como una cadena de razonamientos aparentemente impecables, que conducen sin embargo a contradicciones lógicas.
Seguro que hemos escuchado hablar de alguna paradoja famosa en el campo de las matemáticas o la física. Por ejemplo, la famosa paradoja del Gato de Schrödinger, o la del Diablo de Maxwell. No hay muchas paradojas en el campo de la química que puedan ser contadas de manera divulgativa y que despierten la curiosidad.
Sin embargo, podemos intentarlo con la paradoja de Levinthal. Consiste en el cálculo del tiempo que tardaría una proteína cualquiera en plegarse hasta alcanzar su estructura tridimensional activa. Al mismo tiempo, cómo contrasta dicho resultado con lo que ocurre espontáneamente en la naturaleza.
Cyrus Levinthal fue Biofísico y profesor de Biología Molecular de la Universidad de Columbia (EE.UU.). Destacó entre otros estudios por ser pionero en el diseño con ordenador de imagen 3D de estructuras biológicas, como las proteínas.
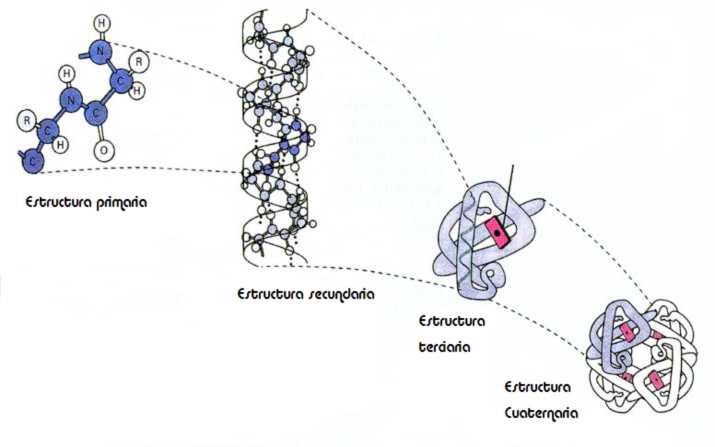
Si recordamos la estructura química de las proteínas, están compuestas por la unión covalente de moléculas llamadas aminoácidos (estructura primaria). Pueden llegar a tener centenares de estos aminoácidos, que se pliegan en el espacio por interacciones intermoleculares. Es decir, pueden crear puentes de hidrógeno, de disulfuro y fuerzas de Van der Vaals hasta alcanzar su estructura activa (terciaria o cuaternaria).
Como químicos, podemos hacernos preguntas. ¿Por qué las proteínas se pliegan siempre de la misma forma? O, ¿por qué no se pliegan de una manera y otras veces de otra? La respuesta es muy sencilla desde el punto de vista de la termodinámica. Se pliegan siempre igual, porque es su forma más estable, la configuración de menor energía.
Este fue el razonamiento que siguió Levinthal:
- Imaginemos una proteína de las más pequeñas, compuesta por 100 aminoácidos . Menos de cien aminoácidos no se considera proteína, se denominan polipéptidos.
- Imaginemos tambíen, que cada aminoácido fuese capaz de adoptar únicamente tres conformaciones distintas (aunque son muchas más las conformaciones posibles).
- El numero total de conformaciones posibles que debería chequear la proteína para llegar a su configuración más estable sería de 3100 (es decir, 5·1047).
Experimentalmente se ha medido en el laboratorio, que el tiempo que necesita un enlace sencillo para girar y una conformación determinada pueda transformarse en otra, es de 10-15 segundos.
Por tanto, el tiempo total de búsqueda de la estructura de menor energía seria de 5·1047 x 10-15 = 5·1032 s (1,6 · 1025 años).

Teniendo en cuenta que la edad del universo se estima en 14.000 millones de años (1.4·1011años), una proteína tardaría 14 veces más en plegarse.
La paradoja es que la mayoría de las proteínas se pliegan de forma espontánea en un tiempo de milisegundos o microsegundos.
Entonces ¿cómo lo hacen?
Una forma de superar la paradoja de Levinthal sería la existencia de una ruta definida de plegamiento que pasara obligatoriamente por determinados estados (intermediarios). Cada uno de ellos debería tener menor energía que el anterior hasta llegar al estado nativo.
Experimentalmente, se han detectado algunos intermediarios del proceso de plegamiento. En particular, en varias proteínas se ha detectado una estructura compacta (globular) que retiene un elevado contenido de las conformaciones locales (estructura secundaria nativa), pero que no mantiene las interacciones de rango mayor (estructura terciaria). A dicha estructura se la conoce como estado de glóbulo fundido.

En la actualidad, datos experimentales sugieren que la ruta de plegamiento en la mayoría de las proteínas no es única. Teniendo en cuenta estos datos, se ha propuesto una solución alternativa a la paradoja de Levinthal.
Se supone que la superficie de energía de la proteína se asemeja a un embudo. La proteína se pliega por rutas diferentes dependiendo de la conformación en la que se encuentre en el estado desplegado. Cada ruta seguiría la línea de menor energía desde esta conformación hasta la estructura nativa.
Una imagen muy ilustrativa de este proceso nos la da la forma en que las gotas de agua alcanzan el fondo de un embudo siguiendo las líneas de máxima pendiente y sin necesidad de recorrer toda la superficie del embudo.

Imágenes tomadas del curso del Máster en Biofísica, Jesús Mendieta, Universidad Autónoma de Madrid y del blog bioquimicauabc108.blogspot.com
Contenido relacionado
 Fotografías científicas
Fotografíaas científicas
Fotografías científicas
Fotografíaas científicas  ¿Qué es un enzima?
¿Qué es un enzima?
Un enzima es un catalizador de reacciones biológicas constituido por una parte de proteína y otra parte que […]
 ¿Qué es una proteína desnaturalizada?
¿Qué es una proteína desnaturalizada?
Se dice que una proteína está desnaturalizada cuando su estructura tridimensional (espacial) se ve alterada por algún motivo: […]



