Sopa de letras: Metales de los grupos I y II

Encuentra los metales de los grupos I y II
La tabla periódica puede considerarse como una cuadrícula en la que se sitúan ordenados los elementos químicos según su número atómico.
Las columnas se denominan grupos y agrupan a elementos cuyas propiedades químicas son muy similares ya que contienen el mismo número de electrones en su última o ultimas capas.
El grupo I, los alcalinos, incluye los siguientes elementos litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs), y francio (Fr). Estos elementos contienen un único electrón en su capa mas externa y tienden a perderlo fácilmente convirtiéndose en un ión positivo. Son maleables, dúctiles y buenos conductores de la electricidad y del calor, su color es blanco plateado y presentan densidades y puntos de fusión bajas. Estas propiedades van cambiando gradualmente dentro del grupo . Son elementos muy reactivos y casi todas sus sales son solubles excepto las del litio.
Puedes encontrar el litio en la batería de tu móvil. El sodio y el potasio son fundamentales para el funcionamiento de la vida animal (bomba sodio-potasio). El rubidio tiende a ser atraído por las células cancerígenas por lo que se ha empleado para localizar tumores en su fase inicial, sus aplicaciones comerciales son escasas ya que, en muchos casos, puede ser sustituido por el sodio que es mucho más económico. El cesio se utiliza en la industria como catalizador, para eliminar trazas de aire en tubos de vacío y puedes encontrar algunas de sus sales en laboratorios para separar y purificar muestras de ADN para investigación bioquímica. Como curiosidad en Japón se vende un gel de cesio como rejuvenecedor de la piel, ya que parece favorecer la producción de enzimas. Por último el francio tiene pocas aplicaciones debido a que es bastante radiactivo.
 Litio
Litio
El grupo II, los alcalino-térreos, incluye al berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba)y radio (Ra). Comparten muchas de las propiedades de los alcalinos pero son un poco menos reactivos y sus puntos de fusión son más elevados, esto se debe a que tienen dos electrones en su capa más externa.
El berilio no absorbe neutrones legando incluso a reflejarlos, esta inusual propiedad lo convierte en un elemento muy interesante para la industria nuclear, tanto en la producción de energía nuclear como en la fabricación de armas. Las carcasas de berilio en determinadas cabezas nucleares favorecen el flujo de neutrones dentro de la bomba. El magnesio es un elemento esencial para casi todos los seres vivos (excepto algunos insectos), en el caso de las plantas verdes constituye el núcleo de la clorofila que les permite realizar la fotosíntesis. Al añadirle trazas de cinc y manganeso se forma una aleación fuerte, resistente a la corrosión y ligera muy interesante para la industria automovilística y la de aviación. El calcio es el metal más abundante en el cuerpo humano, si bien la mayor parte se encuentra en los huesos, el resto realiza funciones metabólicas clave. Las sales de estroncio son las responsables del color rojo de los fuegos artificiales. El sulfato de bario es una de las sales más insolubles no es tóxica y no reacciona con los ácidos gástricos lo que permite su uso en escáneres de rayos X. El radio, altamente radiactivo, se utiliza en medicina.
 Fuegos artificiales de nitrato de estroncio
Fuegos artificiales de nitrato de estroncio
Contenido relacionado
 El berilio en la ciencia ficción
En 1869 el químico Dimitri Mendeléiev presentó su sistema de ordenación de los elementos. Ahora se ha convertido en un icono de la ciencia y la cultura. La ciencia ficción no ha permanecido insensible al potencial de la tabla periódica.
El berilio en la ciencia ficción
En 1869 el químico Dimitri Mendeléiev presentó su sistema de ordenación de los elementos. Ahora se ha convertido en un icono de la ciencia y la cultura. La ciencia ficción no ha permanecido insensible al potencial de la tabla periódica.  La tabla periódica: La curiosa historia de los elementos
La tabla periódica: La curiosa historia de los elementos
Bienvenido a un deslumbrante viaje a través de la historia, la literatura, la ciencia y el arte. Se […]
 Periodic Videos
La Universidad de Nottingham nos presenta esta tabla periódica interactiva en la que al clickar en cada elemento podrás encotrar un video con información sobre el elemento.
Periodic Videos
La Universidad de Nottingham nos presenta esta tabla periódica interactiva en la que al clickar en cada elemento podrás encotrar un video con información sobre el elemento.  Marguerite Perey
Marguerite Perey (Paris 1909- Louvenciennes 1975), química francesa descubridora del francio y primera mujer elegida académica en la Académie des Sciences
Marguerite Perey
Marguerite Perey (Paris 1909- Louvenciennes 1975), química francesa descubridora del francio y primera mujer elegida académica en la Académie des Sciences 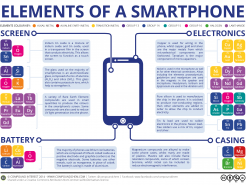 La tabla en tu smartphone
Los elegantes, ligeros y versátiles smartphones del SXXI no son solo obra de genios del diseño y del marketing. Tras esas baterías que nos proporcionan cada vez más autonomía, la electrónica que nos garantiza un gran número de prestaciones, las pantallas de alta resolución y las resistentes carcasas está el trabajo de numerosos científicos e investigadores expertos en nuevos materiales.
La tabla en tu smartphone
Los elegantes, ligeros y versátiles smartphones del SXXI no son solo obra de genios del diseño y del marketing. Tras esas baterías que nos proporcionan cada vez más autonomía, la electrónica que nos garantiza un gran número de prestaciones, las pantallas de alta resolución y las resistentes carcasas está el trabajo de numerosos científicos e investigadores expertos en nuevos materiales. 


