Modelo atómico de Böhr

Einstein y Böhr
Lleva el nombre del físico danés Niels Böhr, quien elaboró en 1913 el primer modelo atómico.
El modelo atómico de Böhr o de Böhr-Rutherford es un modelo clásico del átomo. Está basado en la concepción del modelo de átomo de Rutherford de 1911. A diferencia de éste, introduce una cuantización a partir de ciertos postulados. Explica cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos. Estos dos problemas eran ignorados en el modelo previo de Rutherford.
Se basó en el átomo de hidrógeno para realizar el modelo que lleva su nombre. Con este modelo quería conseguir explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que se observan en los gases. Describió el átomo de hidrógeno con un protón en el núcleo y girando a su alrededor un electrón.
Por tanto, parte conceptualmente de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein. El modelo de Böhr es todavía utilizado frecuentemente como una simplificación de la estructura de la materia.
Contenido relacionado
 La regla del octeto
La regla del octeto
Gilbert N. Lewis postuló en 1916 la regla del octeto, por la que se establece que la tendencia de […]
 Modelo de gases
Todos conocemos este estado de agregación de la materia, puesto que vivimos inmersos en un océano de gases que es la atmósfera, sentimos el viento en la cara, la humedad en los días de niebla...
Modelo de gases
Todos conocemos este estado de agregación de la materia, puesto que vivimos inmersos en un océano de gases que es la atmósfera, sentimos el viento en la cara, la humedad en los días de niebla...  Los gases nobles
Los gases nobles
En 1904, Rayleigh y Ramsay recibieron el premio Nobel de Física y Química, respectivamente, por el descubrimiento de […]
 ¿Qué es el número atómico?
¿Qué es el número atómico?
Atómico significa relativo al átomo, la porción más pequeña en que puede dividirse un elemento químico manteniendo sus […]
 ¿Cómo se forman los enlaces químicos?
¿Cómo se forman los enlaces químicos?
Los enlaces químicos se forman ganando, cediendo o compartiendo electrones para alcanzar configuraciones electrónicas estables como por ejemplo […]
 Construye un átomo
Construye un átomo
Un átomo es la unidad constituyente más pequeña de la materia que tiene las propiedades de un elemento […]
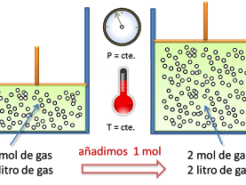 La ley de Avogadro
La ley de Avogadro
El físico italiano Amodeo Avogadro formuló en 1811 la ley de avogadro atraído por el estudio de los gases. La […]
 Ley de Proust o Ley de las proporciones definidas
Ley de Proust o Ley de las proporciones definidas
La ley de Proust, una de las leyes fundamentales de la química, fue enunciada en 1801 para dar […]
 Ley de la Conservación de la Materia
Postula que la cantidad de materia antes y después de una transformación es siempre la misma. Es una de las leyes fundamentales en todas las ciencias naturales. Se resumen con la célebre frase: "nada se pierde, nada se crea, todo se transforma".
Ley de la Conservación de la Materia
Postula que la cantidad de materia antes y después de una transformación es siempre la misma. Es una de las leyes fundamentales en todas las ciencias naturales. Se resumen con la célebre frase: "nada se pierde, nada se crea, todo se transforma".  La formulación química
La formulación química
Fue el químico sueco Jöns Jacob Berzelius quien, en 1813, sentó las bases del actual sistema de formulación química. […]



 Tipos de materiales. Rellena los huecos.
Tipos de materiales. Rellena los huecos. 