La ley de Moseley
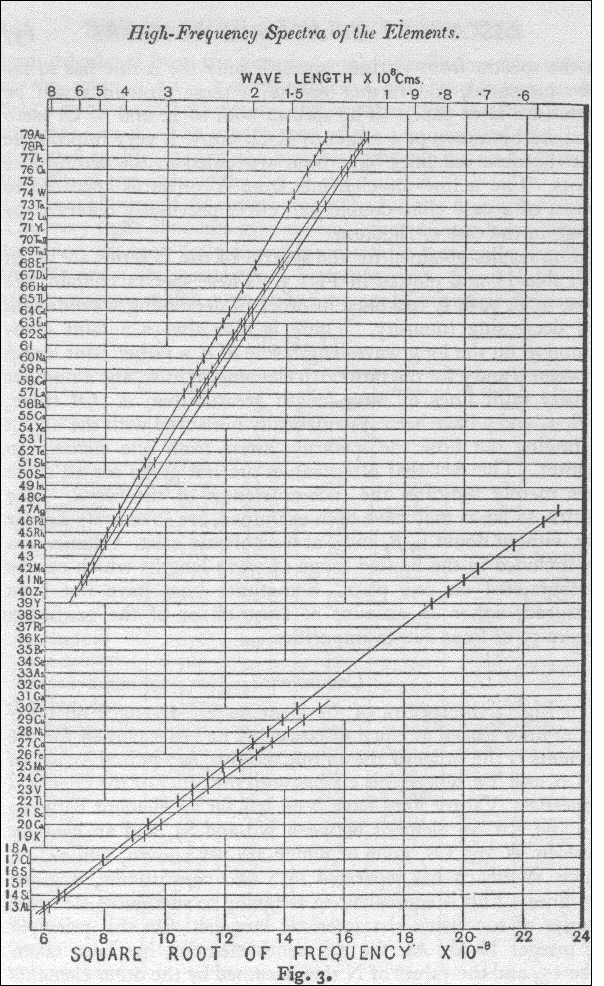
La ley de Moseley es una ley empírica que establece una relación sistemática entre la frecuencia de los rayos x emitidos por distintos átomos con su número atómico. Enunciada en 1913 por el físico británico Henry Moseley, permitió determinar cuántos elementos químicos faltaban por descubrir hasta el uranio.
Henry Moseley, físico inglés comenzó estudió siguiendo las indicaciones de Rutherford, los rayos X emitidos por los metales cuando se bombardean con electrones. En 1913, determinó que cada metal presentaba una frecuencia de emisión característica que era proporcional al cuadrado de un número entero que en los casos analizados, indicaba la posición de cada elemento en la tabla.
![]()
f: frecuencia de la radiación
k1 y k2 Constantes
Z Número atómico
La ley de Moseley determinó que la ley periódica modificara el criterio de ordenación pasando de la masa atómica al número atómico que posteriormente se identificaría con el número de protones en el núcleo.
Teniendo esto en cuenta se podía así determinar el número de elementos que aún quedaban por descubrir, aquellos con número atómico 43, 61, 72, 75, 85, 87 y 91. El último de éstos, el francio, fue descubierto en 1939 por la química francesa Marguerite Perey.
Contenido relacionado
 Henry Moseley
Henry Moseley (Weymouth 1887, Gallipoli 1915) físico inglés que confirmó experimentalmente que el número atómico es el criterio para ordenar los elementos y no la masa atómica.
Henry Moseley
Henry Moseley (Weymouth 1887, Gallipoli 1915) físico inglés que confirmó experimentalmente que el número atómico es el criterio para ordenar los elementos y no la masa atómica.  ¿Cuántos elementos químicos hay?
¿Cuántos elementos químicos hay?
La Unión internacional de Química pura y aplicada (IUPAC) admitió oficialmente a comienzos de 2016 la existencia de 118 […]
 ¿Qué es la tabla periódica?
¿Qué es la tabla periódica?
En 1869, Dmitri Mendeleiév presentó su primera versión de la tabla periódica compuesta por 63 elementos iniciales, convirtiéndose […]



