La ley de Avogadro
El físico italiano Amodeo Avogadro formuló en 1811 la ley de avogadro atraído por el estudio de los gases.
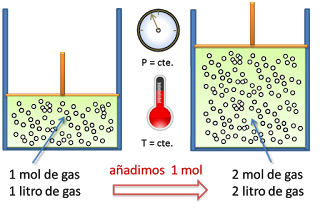
La ley de Avogadro afirma que las masas de un volumen patrón de diferentes gases (densidades) son proporcionales a la masa de cada molécula individual.
Es decir, afirma que dos volúmenes iguales de gases diferentes contienen el mismo número de moléculas. Aunque esto sólo se observa si sus condiciones de temperatura y presión son las mismas. Por tanto, dos botellas idénticas, una llena de oxígeno y otra de helio, contendrán exactamente el mismo número de moléculas. Sin embargo, el número de átomos de oxígeno será dos veces mayor puesto que el oxígeno es diatómico.
Contenido relacionado
 Amodeo Avogadro
Amodeo Avogadro
Amodeo Avogadro (Turín, 1776 -1856) formuló la ley que lleva su nombre por la que consiguió explicar por […]
 ¿Qué es un mol?
El mol es la unidad utilizada para expresar la cantidad de una determinada sustancia en el Sistema Internacional de unidades (SI).
¿Qué es un mol?
El mol es la unidad utilizada para expresar la cantidad de una determinada sustancia en el Sistema Internacional de unidades (SI).  El mol
Hay muchas formas distintas de medir la cantidad de materia. El mol es la cantidad de materia que contiene el número de Avogadro de partículas constituyentes.
El mol
Hay muchas formas distintas de medir la cantidad de materia. El mol es la cantidad de materia que contiene el número de Avogadro de partículas constituyentes.  La formulación química
La formulación química
Fue el químico sueco Jöns Jacob Berzelius quien, en 1813, sentó las bases del actual sistema de formulación química. […]
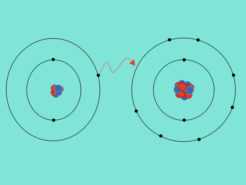 ¿Cómo se forman los enlaces químicos?
¿Cómo se forman los enlaces químicos?
Los enlaces químicos se forman ganando, cediendo o compartiendo electrones para alcanzar configuraciones electrónicas estables como por ejemplo […]



