Amodeo Avogadro
Amodeo Avogadro (Turín, 1776 -1856) formuló la ley que lleva su nombre por la que consiguió explicar por qué los gases se combinan en proporciones simples.
Amodeo Avogadro avanzó así en el estudio y desarrollo de la teoría atómica. La ley de Avogadro dice que volúmenes iguales de gases distintos, bajo las mismas condiciones de presión y temperatura, contienen el mismo número de partículas. En su honor, se le dio también el nombre al Número de Avogadro.
Químico y físico italiano, en 1792 se graduó como doctor en derecho canónico, pero no ejerció. Realizó estudios científicos tardíos, mostrando verdadera pasión por la física y la química, y gran destreza para las matemáticas. En 1820, la Universidad de Turín creó para él una cátedra de física, que ocupará hasta su muerte.
Contenido relacionado
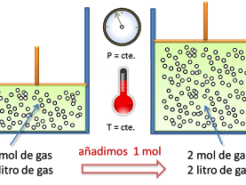 La ley de Avogadro
La ley de Avogadro
El físico italiano Amodeo Avogadro formuló en 1811 la ley de avogadro atraído por el estudio de los gases. La […]
 La formulación química
La formulación química
Fue el químico sueco Jöns Jacob Berzelius quien, en 1813, sentó las bases del actual sistema de formulación química. […]
 ¿Qué es un mol?
El mol es la unidad utilizada para expresar la cantidad de una determinada sustancia en el Sistema Internacional de unidades (SI).
¿Qué es un mol?
El mol es la unidad utilizada para expresar la cantidad de una determinada sustancia en el Sistema Internacional de unidades (SI).  El mol
Hay muchas formas distintas de medir la cantidad de materia. El mol es la cantidad de materia que contiene el número de Avogadro de partículas constituyentes.
El mol
Hay muchas formas distintas de medir la cantidad de materia. El mol es la cantidad de materia que contiene el número de Avogadro de partículas constituyentes. 


