¿Cómo se forman los enlaces químicos?
Compuestos y propiedades Para empezar Reacciones
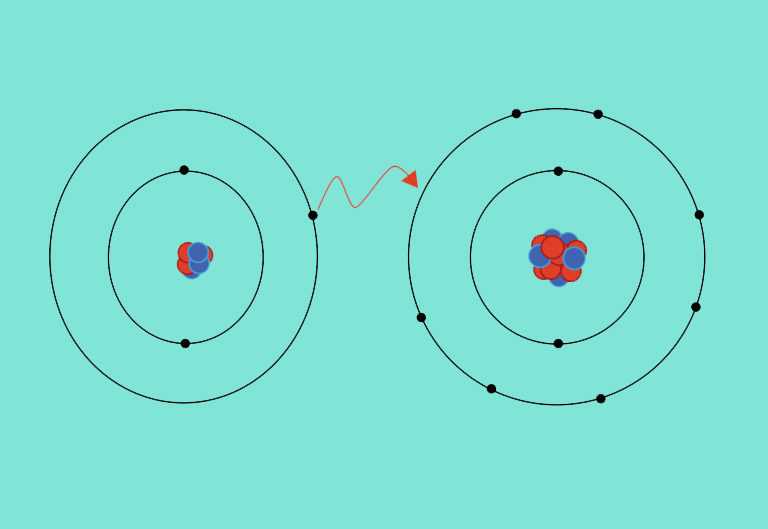
Los enlaces químicos se forman ganando, cediendo o compartiendo electrones para alcanzar configuraciones electrónicas estables como por ejemplo las de los gases nobles.
Los átomos electropositivos ceden electrones hasta completar la configuración más estable, con lo que quedan con un defecto de carga negativa. Los elementos electronegativos por su parte capturan electrones y quedan con un exceso de carga negativa. Las entidades así formadas se llaman iones: cationes si la carga resulta positiva (+) y aniones si es negativa (-). Entre ambas partículas cargadas puede establecerse un enlace iónico, formándose una sal.
En otras ocasiones dos átomos comparten pares de electrones y quedan enlazados formando una molécula, de manera que la configuración de la nube electrónica que ahora rodea a los dos núcleos resulta más estable. Los electrones compartidos pueden proceder de ambos átomos, lo que se conoce como enlaces covalentes, típicos en los materiales de origen biológico, o de uno solo de ellos, en cuyo caso caso se dice que el enlace es covalente coordinado, muy habituales en los elementos de transición.
Otra posibilidad es que muchos átomos de elementos metálicos compartan electrones entre todos. En estos casos se forma una red ordenada de átomos y los electrones compartidos se mueven libremente entre ellos. Es lo que se conoce como enlace metálico.
Covalentes, iónicos y metálicos son los enlaces que almacenan más energía y, por tanto, necesitan más energía para romperse. ¡Pero hay más tipos! Por ejemplo los enlaces por puentes de hidrógeno.
Contenido relacionado
 ¿En qué proporciones se unen unos elementos con otros?
¿En qué proporciones se unen unos elementos con otros?
Los elementos químicos se unen en función de sus ‘valencias’ tomando como referencia el hidrógeno. Esto quiere decir que un elemento puede […]
 ¿Qué es un elemento químico?
¿Qué es un elemento químico?
Un elemento químico es una sustancia pura (o especie química definida) cuyas propiedades intrínsecas lo diferencian de otros […]
 ¿Qué es el número atómico?
¿Qué es el número atómico?
Atómico significa relativo al átomo, la porción más pequeña en que puede dividirse un elemento químico manteniendo sus […]



